Was Sie über Stammzellen und Stammzelltherapien wissen sollten
Sie haben vielleicht in den Nachrichten von Stammzellen gehört oder ein Freund hat es erwähnt. Nachdem Sie online nach mehr Informationen gesucht haben, sind Sie möglicherweise auf Webseiten oder wissenschaftliche Zeitschriften gestoßen, in denen das Thema auf sehr komplizierte Weise diskutiert wird.
Zwar gibt es viele Menschen, die sich für stammzellbasierte Behandlungen interessieren, aber es gibt auch eine Menge irreführende Informationen darüber, was Stammzellen sind und wie stammzell-basierte Therapien angewendet werden können. Entgegen der landläufigen Meinung ist es häufig z.B. nicht möglich, durch eine einzige Stammzellinjektion oder Therapiesitzung eine Krankheit zu behandeln. Es erfordert oft eine Reihe von Sitzungen und einen personalisierten Behandlungsplan. Viele Krankheiten sind weder mit konventionellen, noch mit Stammzelltherapien heilbar. Dies umfasst bisher z.B. Morbus Parkinson (PD), Multiple Sklerose (MS), Amyotrophe Lateralsklerose (ALS) und Arthrose.
Wenn Sie also eine Stammzellenbehandlung für Ihre Erkrankung in Betracht ziehen oder einfach mehr darüber erfahren möchten, sind Sie hier genau richtig. Hier fassen wir alle wichtigen Dinge, die Sie über Stammzellen wissen müssen, auf einfachste Weise zusammen, damit Sie Ihre Entscheidung bezüglich Ihrer Behandlung mit genügend Hintergrundinformationen treffen können.
In welcher Klinik lassen Sie sich behandeln?
Der wichtigste Punkt bei der Auswahl einer Stammzell-Behandlung sollte immer Ihre Sicherheit sein. Achten Sie darauf, dass die Stammzellklinik behördlich kontrolliert ist und unter GFP/GMP arbeitet. Im medizinisch-pharmazeutischen Bereich gibt es keine Zertifizierung wie bei ISO-Normen, sondern Behörden erteilen z.B. Herstellungserlaubnisse. In Deutschland sind hierfür die Regierungspräsidien der Länder und das Paul-Ehrlich-Institut verantwortlich. Sie erteilen nur dann Erlaubnisse zur Gewebeentnahme und Herstellung von Stammzellprodukten nach dem Arzneimittelgesetz (§13 und §20b, c AMG), wenn die gleichbleibende Qualität der Stammzellen gewährleistet ist und die Herstellung so erfolgt, dass keine Bedenken in Bezug auf die Sicherheit der Patienten gegeben sind. Hier spielt die Qualitätskontrolle eine wichtige Rolle. Wichtige Fragen: Hat die Klinik in Deutschland eine Herstellerlaubnis oder eine Entnahmeerlaubnis? Hat eine internationale Klinik eine Erlaubnis der zuständigen Behörde? Eine Liste der zuständigen internationalen Arzneimittelbehörden finden Sie hier. Die ANOVA IRM in Offenbach am Main hat seit 2018 entsprechende Erlaubnisse für BMC und Sekretom.
Sind allogene oder autologe Stammzelltherapien besser?
Vergleichen Sie die angebotenen Produkte. Allogene Produkte von Fremdspendern sind immer mit mehr Risiko verbunden, als autologe Stammzellen (Spender und Empfänger sind die gleiche Person). Diese größeren Risiken umfassen die Übertragung von Krankheitserregern (Viren, Bakterien) und allergische Reaktionen. Allogene Produkte sollten nur angewendet werden, wenn sie immunologisch unbedenklich sind oder das Matching von Spender und Empfänger geprüft wurden. Wichtige Fragen: Ist das Produkt autolog? Wenn nicht, wie wird das matching geprüft? Wie werden die Spender getestet? Eine auf dem aktuellen behördlichen Stand ausreichende Testung beinhaltet Hepatitis B und C, HIV 1 und 2 sowie Treponema pallidum (Syphillis). Weitere Krankheiten werden in der Regel nicht getestet. Daher sind autologe Stammzellen in sofern sicherer, dass sie keine Infektionskrankheiten vom Spender übertragen können.
Wieviel Zeit braucht eine Stammzelltherapie? Wie ist die Dauer?
Viele Patienten wollen schnell behandelt werden. Allerdings sollte man darauf achten, dass Produkte nur dann sicher sind, wenn auch die Patienten vorher getestet werden. Hierzu nutzt man Blutuntersuchungen, die in der Regel 1 Tag in Anspruch nehmen. Wenn Sie vorab nicht getestet werden, können sie nicht sicher sein, ob vorherige Patienten die Räumlichkeiten mit Bakterien oder Viren kontaminiert haben. Frage an die Klinik: welche Tests zur Spenderselektion führen sie vorab durch?
Vorsicht vor tierischen Stammzellen, Frischzellen und unklaren Produkten!
Tierische Stammzellprodukte können sehr gefährlich sein und sollten nicht angewendet werden. Informieren sie sich vorab immer bei der zuständigen Behörde. Alle Produkte, die nicht klar und transparent erläutert werden, sollten als fragwürdig angesehen werden. Fragen Sie bei allen allogenen Therapien explizit nach den Spendern und der Spendertestung, also worauf die Spender gestestet wurden.
Wir raten von SVF - stromal vascular fraction - ab!
Die stromal vascular fraction (SVF) ist ein Produkt das wir nicht anbieten. Es wird aus Fettgewebe in einem ca. 2-stündigen Isolationsverfahren gewonnen und enthält nur wenige Stammzellen. Durch die manuelle, offene Isolation kann es zu Kontaminationen kommen. Da SVF direkt nach der Isolation angewendet wird, kann keine ausreichende Qualitätskontrolle durchgeführt werden, um eine potentielle Kontamination zu entdecken. BMC dagegen wird z.B. in einem geschlossenen System isoliert und MSC werden normalerweise kultiviert, was die Zeit bringt, eine intensive Qualitätskontrolle durchzuführen.
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben Sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
Wie wirken Stammzellen? Wirkhypothesen bei Stammzellbehandlungen
Stammzellen werden zwei grundlegende Wirkmöglichkeiten zugesprochen:
- Die Immunmodulation (Beeinflussung des Immunsystems, meist eine Hemmung überschießender Immunreaktionen)
- Die Förderung der Regeneration im Gewebe
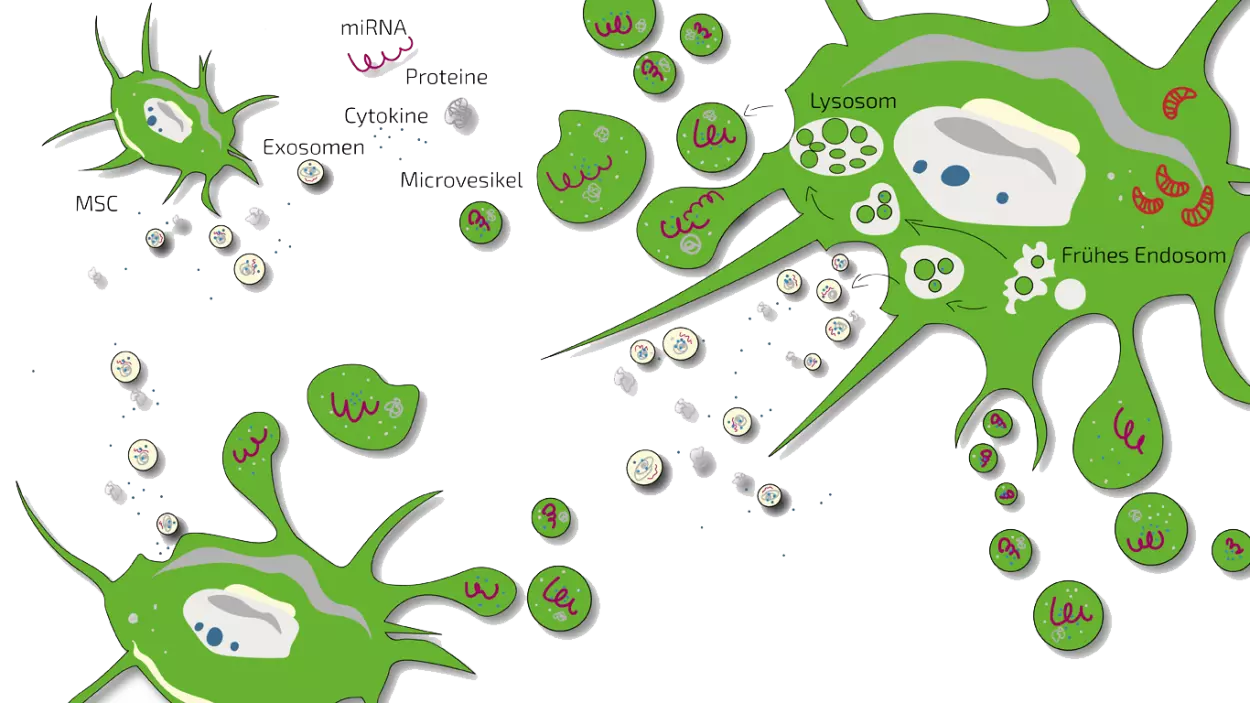
In den ersten Jahren der Forschung an Stammzellen hat man angenommen, Stammzellen würden geschädigtes Gewebe ersetzen, indem sie sich ins Gewebe "einbauen". Heute weiß man, dass dies nicht der Fall ist. Stammzellen wirken eher als Moderatoren und Modulatoren. Dies bedeutet, dass wenn man Stammzellen in einen entzündeten Bereich injiziert, diese dort das Immunsystem modulieren, also starke Entzündungen hemmen, indem sie die auslösenden Immunzellen "kommunikativ überzeugen" die Entzündung abklingen zu lassen. Die Kommunikation erfolgt über Botenstoffe, die von der Stammzelle abgegeben werden und entweder außen an der Immunzelle binden und Signale auslösen oder von der Immunzelle aufgenommen werden und dann im Inneren ein Signal auslösen. Die "Kommunikatoren" bezeichnet man in ihrer Gesamtheit als das Sekretom, welches Exosomen, Mikrovesikel, Cytokine, miRNA (Micro-RNA) und Proteine enthält. Diese Moderation bezeichnet man als Immunmodulation.
Der zweite Effekt, den Stammzellen haben können, ist die Förderung der Regeneration. Stammzellen "motivieren" die Zellen im geschädigten Gewebe dazu sich zu teilen, Verletzungen oder Schäden zu regenerieren und somit eine Heilung einzuleiten. Oft ist die Regeneration im geschädigten Gewebe blockiert, weil eine Entzündung vorliegt. Hier können Stammzellen dann beide Effekte nacheinander ausüben. Der genaue Weg wie Stammzellen dies erreichen, ist nicht geklärt, daher gibt es diese Botenstoffe bisher nicht als Medikamente sondern man nutzt Stammzellen und deren Botenstoffe (Sekretom, Exosomen), um Krankheiten zu behandeln.
Was sind Stammzellen?
Eine Stammzelle ist ein ganz besonderer Zelltyp, der sich zu vielen verschiedenen Zelltypen im Körper entwickeln kann. Solche Stammzellen sitzen in vielen Geweben des menschlichen Körpers, auch bis ins hohe Alter. Während pluripotente Stammzellen sich in alle Körperzellen entwickeln (differenzieren) können, sind die Stammzellen für Therapien nur multipotent, d.h. sie können sich in mehrere Zelltypen, aber nicht alle Zelltypen differenzieren.
Durch ihr regeneratives Potential werden sie zu einem wichtigen Bestandteil des Reparaturmechanismus des Körpers. Indem sie sich nach z.B. einer Verletzung fast unbegrenzt teilen können, können sie benötigte Zellen ersetzen. Und bei jeder neuen Teilung kann entweder eine Stammzelle oder ein anderer Zelltyp mit einer besonderen Funktion entstehen.
Im Wesentlichen können sich z.B. Blutstammzellen (hämatopoietische Stammzellen) aus dem Knochenmark in Blutzellen differenzieren, mesenchymale Stammzellen aus dem Knochenmark oder Fettgewebe können sich in Knochen-, Knorpel-, Fett- oder sogar Gehirnzellen werden.
Einteilung von Stammzellen
Man kann Stammzellen grob nach 5 Kategorien einteilen:
- Potential: pluripotent - multipotent
- Ausrichtung: hämatopoietische Stammzellen (blutbildend)
- Herkunft: z.B. Knochenmark, mesenchymale Stammzellen
- Alter des Spenders: embryonale und adulte ("erwachsene") Stammzelllen
- Anwendung: autolog (Spender und Empfänger identisch), allogen (auch homolog genannt, Fremdspender human)
Was sind embryonale Stammzellen?
Embryonale Stammzellen sind eine spezielle Art von Stammzellen, die pluripotent sind. Das bedeutet, dass sie sich in jeden Zelltyp verwandeln können. Embryonale Stammzellen haben das höchste regenerative Potential, sind jedoch im erwachsenen Menschen nicht mehr vorhanden.
In vielen Staaten haben die ethischen Probleme hinsichtlich der Methode zur Gewinnung embryonaler Stammzellen dazu geführt, dass ihre Nutzung verboten ist und auch die Forschung extrem eingeschränkt ist. In Deutschland ist die Nutzung embryonaler Stammzelllen verboten. In der ANOVA verwenden wir nur autologe Stammzellen, also solche die wir auf sichere und ethische Weise aus dem Gewebe des Patienten selbst gewinnen. Die gewonnenen Stammzellen werden nur bei genau diesem Patienten, also dem Spender angewendet.
Was sind adulte Stammzellen?
Stammzellen sind während unseres gesamten Lebens in Körpern von Kindern und Erwachsenen vorhanden. Stammzellen kommen in fast allen Geweben vor. Bekannte Gewebe mit Stammzellanteil sind z.B. das Knochenmark und das Fettgewebe, aber auch im Gehirn wurden Stammzellen nachgewiesen.
Warum haben wir adulte Stammzellen?
Adulte Stammzellen werden gebraucht, um das Gewebe in dem sie sich befinden, schnell zu reparieren. Sie sind also Teil des Selbstheilungs- und Regenerations-Systems unseres Körpers.
Wo kann man adulte Stammzellen finden?
Sie befinden sich in vielen Organen und Geweben, einschließlich Gehirn, Knochenmark, Blut, Muskel, Haut und vielen anderen Bereichen. Aus diesem Grund ist die Verwendung adulter Stammzellen die beliebteste und ethisch am besten vertretbare Wahl für die Stammzelltherapie.
Hier bei ANOVA verwenden wir für unsere angebotenen Stammzellbehandlungen entweder mesenchymale Stammzellen (MSCs) aus Fettgewebe oder aus Stammzellen, die aus Knochenmark (BMC) gewonnen werden können. Die Gewinnung von Stammzellen aus dem eigenen Körper des Patienten (autologe Zellen) hat, wie jeder kleine medizinische Eingriff, nur geringe Auswirkungen auf die Gesundheit des Patienten.
Was ist der Unterschied zwischen embryonalen und adulten Stammzellen?
Embryonale und adulte Stammzellen unterscheiden sich in ihren Fähigkeiten. Sie unterscheiden sich auch in Anzahl und Art der Zellen, die sie werden können. Genauer gesagt können adulte Stammzellen nur in mehrere Zelltypen umgewandelt werden (multipotent), aber embryonale Stammzellen können alle Zelltypen des Körpers werden (pluripotent).
Embryonale und adulte Stammzellen können nach der Entnahme aus einem Spender in einem Labor gezüchtet werden. Die Nutzung embryonaler Stammzellen ist in Deutschland verboten. In der ANOVA werden nur adulte Stammzellen, die direkt vom selbem Patienten stammen, verwendet. Diese sogenannten autologen Stammzellen machen es sehr unwahrscheinlich, dass sie nach dem Eingriff vom Immunsystem des Patienten abgestoßen werden. Dies ist einer der Gründe, warum wir uns bei ANOVA für die Verwendung adulter Stammzellen entschieden haben.
Was sind pluripotente Stammzellen?
Pluripotenz ist ein Merkmal einer Zelle und kein separater Zelltyp. Dieses Merkmal bedeutet, dass sie sich selbst replizieren (vermehren) und sich zu allen anderen Arten von Zellen oder Geweben im Körper entwickeln können. Natürlicherweise sind nur embryonale Zellen pluripotent. In Forschungslaboren wird aber gerade erforscht, wie man natürliche adulte Stammzellen oder sogar normale Körperzellen in pluripotente Stammzellen umwandeln kann. Diese sogenannten induzierten pluripotenten Stammzellen (iPS-Zellen oder iPSC) könnten vielleicht in Zukunft genutzt werden, um ganze Organe für die Organtransplantation zu züchten.
Was sind hämatopoetische Stammzellen?
Hämato-poietische (blut-bildende) Stammzellen sind eine Untergruppe der adulten Stammzellen. Sie stammen aus dem Knochenmark. Sie werden auch als „Blutstammzellen“ bezeichnet und können in alle Arten von Blutzellen differenzieren, einschließlich weißer Blutkörperchen, roter Blutkörperchen und Blutplättchen. Sie finden sich normalerweise im Knochenmark und wandern von dort ins periphere, in der Blutbahn befindliche Blut. Hämatopoietische Stammzellen sind somit auch multipotente Stammzellen.
Was sind multipotente Stammzellen?
Diese Zellen haben die Möglichkeit, sich selbst zu erneuern. Nachdem sie sich geteilt haben, können sie sich zu verschiedenen Arten spezialisierter Zellen entwickeln. Daher sind die meisten adulten Stammzellen multipotente Stammzellen.
Was sind mesenchymale Stammzellen?
Mesenchymale Stammzellen oder MSCs sind eine Art multipotenter Stammzellen, die sich in eine Vielzahl von Zelltypen verwandeln können, einschließlich Fettzellen, Knochenzellen, Muskelzellen, Knorpelzellen und mehr.
Wie bereits erwähnt, ist dies der Stammzelltyp, den wir bei ANOVA verwenden.
Haben Pflanzen Stammzellen?
Pflanzen haben natürlich keine menschlichen Stammzellen aber pflanzliche Wachstumsgewebe (z.B. das für Dickenwachstum relevante Kambium). Diese sind im Vergleich zu tierischen außergewöhnlich, weil Pflanzen im Gegensatz zu Tieren lebenslang wachsen können.
Warum sind Stammzellen wichtig?
Sie haben verschiedene potentielle Einsatzbereiche, sowohl in der Forschung als auch in der Medizin:
- Sie haben das Potenzial, beschädigtes Gewebe zu regenerieren und zu reparieren. Aufgrund dieser Qualität sind sie interessant als experimentelle Therapieoption für Menschen mit:
- Rückenmarksverletzungen
- Parkinson-Krankheit
- ALS oder Amyotrophe Lateralsklerose
- Alzheimer-Erkrankung
- Herzkrankheit
- Diabetes Typ 1
- Schlaganfall
- Verbrennungen
- Arthrose und Arthritis
- Forscher untersuchen Stammzellen auch, um zu verstehen, wie Krankheiten auftreten und wie sie am besten bekämpft werden können. Man kann zum Beispiel durch die Untersuchung, wie sie sich zu verschiedenen Arten von Zellen entwickeln, besser verstehen, wie Krankheiten beginnen und sich entwickeln.
- Sie können auch verwendet werden, um neue Arzneimittel sowie deren Sicherheit und Qualität zu testen Test-Modelle). Da sie andere Zelltypen replizieren können, können sie die Eigenschaften der Zelltypen übernehmen, auf die ein bestimmtes Medikament abzielt. Wenn beispielsweise ein neues Arzneimittel gegen Herzerkrankungen getestet wird, kann es bei Stammzellen angewendet werden, die zu Herzzellen reifen. Die Forscher können so herausfinden, ob die Zellen während der klinischen Prüfung des Arzneimittels geschädigt wurden und können bewerten, ob die Verabreichung an Patienten sicher ist.
- Stammzellen können in Kultur auch zu funktionalisierten Zellen differenziert werden. MSC z.B. können sich zu Fettgewebe, Knochen, Knorpel und Nervenzellen entwickeln. Knorpel der aus MSC hergestellt wird, kann Patienten dann z.B. in ein Knie transplantiert werden.
- Sie können auch verwendet werden, um neue Arzneimittel sowie deren Sicherheit und Qualität vor den klinischen Studien in Kultur zu testen (präklinische Test-Modelle). Wenn beispielsweise ein potentielles neues Arzneimittel gegen Herzerkrankungen getestet wird, kann es bei Stammzellen angewendet werden, die zu Herzzellen reifen. Die Forscher können so herausfinden, ob die Zellen durch das Arzneimittel geschädigt wurden und können bewerten, ob die Verabreichung an Patienten sicher ist.
- Ein Bereich der noch nicht sehr weit entwickelt ist, ist der Versuch aus Stammzellen, meist iPSCs und anderen menschlichen Zellen, ganze Organe wie z.B. eine Leber zu züchten. Sehr beeindruckende erste Ergebnisse hat hierzu das Fraunhofer Institut erzielt.
Woher kommen Stammzellen?
Forscher haben mehrere Quellen identifiziert:
- Embryonal - stammen von Embryonen, die drei bis fünf Tage alt sind.
- Adult - können aus Geweben wie Knochenmark oder Fett gewonnen werden.
- Perinatal - Sie befinden sich im Fruchtwasser und im Blut der Nabelschnur. Sie haben auch die Fähigkeit, sich in spezialisierte Zellen zu verwandeln.
Wer hat Stammzellen entdeckt?
Es gibt eine anhaltende Debatte darüber, wer genau sie entdeckt hat. Ihre Entdeckung wird häufig den kanadischen Wissenschaftlern Dr. James Till und Ernest McCulloch zugesprochen. Sie wurden jedoch in wissenschaftlichen Fachzeitschriften bereits vor der Erwähnung durch Till und McCullochs wegweisenden Studien zur hämatopoetischen Stammzellforschung erwähnt.
Wann wurden Stammzellen entdeckt?
Vor Till und McCullochs Forschung von 1963 gab es viele Studien, in denen der Begriff "Stammzellen" verwendet wurde. Die frühesten stammen aus den 30er und 40er Jahren.
Beispielsweise erwähnte die amerikanische Wissenschaftlerin Dr. Florence Sabin in einem Forschungsbericht von 1932 die Auswirkungen von Strahlung auf eine bestimmte Art von Zellen, die sich als hämatopoetische Stammzellen herausstellten.
1936 veröffentlichte dieselbe Dr. Sabin einen Artikel über die Beziehung zwischen Stammzellen und weißen Blutkörperchen.
Was Till und McCullochs Artikel von früheren Arbeiten unterschied, war, dass sich ihre Forschung auf hämatopoetische Stammzellen konzentrierte, während andere sich auf Stammzellen von hämatopoetischen Tumoren konzentrierten.
Wann hat die Forschung an Stammzellen richtig begonnen?
Wissenschaftler arbeiten normalerweise mit zwei Arten von Stammzellen: embryonalen und nichtembryonalen oder "adulten" Stammzellen. Dies begann 1981, als Wissenschaftler Stammzellen aus Mausembryonen extrahierten. 1988 half diese Studie Forschern, sie aus menschlichen Embryonen zu gewinnen, die später in Laboratorien gezüchtet wurden.
Ungefähr zwei Jahrzehnte später haben Wissenschaftler spezialisierte adulte Stammzellen genetisch so umprogrammiert, dass sie wie eine Stammzelle funktionieren. Diese werden als induzierte pluripotente Stammzellen bezeichnet, und dieser Durchbruch ebnete den Weg für neue Forschungen und Behandlungen.
Wie werden embryonale Stammzellen gewonnen?
Die Gewinnung von Stammzellen kann auf viele Arten geschehen. Die Art und Weise, wie sie extrahiert werden, beeinflusst, wie sie bei der Erforschung oder Behandlung von Krankheiten eingesetzt werden.
Zuvor wurden embryonale Stammzellen durch Tötung eines menschlichen Embryos gewonnen, was natürlich sehr kontrovers diskutiert wurde. In neueren, fortgeschritteneren Techniken wurde dieser Prozess eliminiert, da festgestellt wurde, dass sie aus Blastomeren extrahiert werden können, einer Zelle, die auf der äußeren Schicht einer befruchteten Eizelle gebildet wird. Dies vermeidet die Tötung eines Embryos; kontrovers bleibt allerdings auch dieser Ansatz.
Andererseits können adulte Stammzellen direkt von der Quelle gewonnen werden, wo sie auch verwendet werden würden. Für die Behandlung von Blutkrankheiten benötigen Sie beispielsweise eine Blutstammzelle. Und Sie können sie aus dem Knochenmark extrahieren, wo Blut produziert wird.
Bei ANOVA stellen wir sicher, dass wir Stammzellen auf ethische und sichere Weise gewinnen. Für alle unsere Behandlungen verwenden wir das eigene Fett oder Knochenmark des Patienten, um mesenchymale Stammzellen für unsere Behandlungen zu extrahieren. ANOVA verwendet keine embryonalen Stammzellen.
Wie werden mesenchymale Stammzellen gewonnen?
Mesenchymale Stammzellen können aus verschiedenen Quellen extrahiert werden.
Stammzellen aus Fettgewebe werden mithilfe einer Fettabsaugung extrahiert, die die Entfernung von Fett ermöglicht, ohne Ihre Zellen zu zerstören. Gleichzeitig erfordert dieses minimalinvasive Verfahren nur eine Lokalanästhesie und eine leichte Sedierung. Anschließend wird das Fett zur weiteren Verarbeitung im Labor in einen sterilen Behälter überführt, um die Zellfraktion zu extrahieren.
Stammzellen können auch aus dem Knochenmark extrahiert werden. Dies kann auch unter örtlicher Betäubung durchgeführt werden. Lesen Sie mehr über Knochenmarkkonzentrat hier.
Wofür können Stammzellen verwendet werden?
Stammzellen können sowohl für die Forschung als auch für die Therapie verwendet werden.
Eine der wichtigsten Anwendungen ist natürlich ihre Verwendung für stammzellbasierte Therapien. Die Stammzelltherapie kann bei einer Reihe von Erkrankungen angewendet werden.
Heutzutage werden gespendete Organe verwendet, um fehlerhafte Organe zu ersetzen. Diese Option führt jedoch aufgrund des Mangels an geeigneten Spendern zu langen Wartelisten. Stammzellen können eine sehr elegante und effiziente Alternative sein, da sie in bestimmte Zelltypen differenzieren können, die die beschädigten Zellen ersetzen können. Das Gute an ihnen ist, dass sie eine erneuerbare Quelle sind und Patienten nicht auf einen Spender warten müssen.
Wie bereits erwähnt, können Stammzellen auch zu Forschungszwecken verwendet werden. Forschungen auf dem Gebiet der embryonalen Stammzellen können uns beispielsweise helfen, besser zu verstehen, was während der menschlichen Entwicklung geschieht. Mithilfe von Forschungen können Wissenschaftler den Prozess verstehen, wie genau Stammzellen sich zu anderen Zellen entwickeln.
Die Forschung auf diesem Gebiet trägt in hohem Maße zu den laufenden Studien über schwerwiegende Erkrankungen wie Krebs und Entwicklungsstörungen bei. Dies liegt daran, dass diese Krankheiten durch atypische Zellteilung und Differenzierung verursacht werden. Wenn wir diese Prozesse besser verstehen, sind wir der Suche nach Heilmitteln und Therapiestrategien einen Schritt nähergekommen.
Stammzellen können auch zum Testen neuer Medikamente verwendet werden. Beispielsweise werden neue Arzneimittel an differenzierten Zellen getestet, die aus menschlichen pluripotenten Stammzellen erzeugt wurden.
Ist es möglich, Stammzellen auf natürliche Weise zu vermehren?
Es gibt zwar Studien, die darauf hinweisen, wie ihre Produktion in Mäusen gesteigert werden kann, wie diese Studie des Massachusetts Institute of Technology aus dem Jahr 2018, die eine schnellere Regeneration nach 24-Stunden langem Fasten impliziert. Allerdings ist Fasten bzw. das Halten eines eher niedrigen Körpergewichts generell gesünder und verlängert bei Mäusen das Leben.
Deckt die Krankenversicherung eine Stammzelltherapie ab?
Behandlungsprogramme in der ANOVA werden derzeit nicht von der Krankenkasse übernommen. Sie sind nur gegen Selbstzahlung erhältlich.
Wie kann ich Stammzellen spenden?
ANOVA ist keine Knochenmark-Spendeeinrichtung. Während es andere Kliniken gibt, die Knochenmark-Spenden einlagern, um z.B. Leukämiepatienten zu behandeln, entnimmt die ANOVA nur Gewebe zur Herstellung von autologen Stammzellprodukten. Für unsere Therapien extrahieren wir die adulten Stammzellen aus dem Fettgewebe oder Knochenmark unserer eigenen Patienten, was ihre immunologische Kompatibilität garantiert und das potentielle Nebenwirkungsrisiko senkt.
Wie sehen Stammzellen aus?
Jeder Zelltyp hat seine eigene Größe und Struktur, die für seine Aufgabe geeignet ist.
Beispielsweise übermitteln Gehirnzellen Befehle an den Körper, sodass sie wie Netze geformt sind, da sie die verschiedenen Arten von Zellen erreichen müssen, die sie umgeben.
Selbst wenn diese Zellen unterschiedliche Funktionen haben, bestehen sie alle aus denselben Hauptkomponenten:
- Kern - Enthält DNA, die Informationen über den Körper enthält.
- Zytoplasma - Flüssigkeit, die den Kern umgibt und die Materialien enthält, die die Zelle für ihre Arbeit benötigt.
- Zellmembran - Oberfläche der Zelle, die Signale von anderen Zellen empfängt und sendet, damit diese ihre Aufgaben ausführen können.
Wie funktioniert Stammzelltherapie?
Die Art und Weise, wie die Therapie funktioniert, hängt vom Ansatz ab. Es gibt zwei grundlegend unterschiedliche Ansätze für die Stammzelltherapie.
Beim ersten Ansatz werden Stammzellen aus der Quelle extrahiert und dort, wo sie benötigt werden, erneut in den Patienten appliziert. Dort können Stammzellen die Regeneration und Gewebereparatur einleiten.
Die Quelle kann Fettgewebe, Knochenmark oder anderes Gewebe aus dem eigenen Körper des Patienten sein. Der Ort und die Art der Anwendung hängen von der behandelten Erkrankung ab.
Bei ANOVA extrahieren wir Knochenmarkkonzentrat und applizieren die gewonnen MSCs inklusive Wachstumsfaktoren.
Beim zweiten Ansatz werden Stammzellen ebenfalls aus denselben Quellen extrahiert, sie werden jedoch zur Herstellung eines Stammzellsekretoms verwendet. Bei diesem Ansatz werden nicht die Zellen appliziert, sondern das zellfreie Stammzellsekretom.
Das Sekretom, oft auch Exosomen genannt, ist definiert als die Summe aller löslichen Moleküle (z.B. Wachstumsfaktoren und Zytokine), die von der Zelle freigesetzt werden. Diese Moleküle werden hauptsächlich von der Zelle verwendet, um mit anderen Zellen zu kommunizieren. Sie können unterschiedliche Mechanismen in den umgebenden Zellen auslösen.
Warum ist das Stammzellsekretom wirksam? Aktuelle Forschungsergebnisse haben gezeigt, dass die wichtigsten regenerativen Wirkungen von Stammzellen von diesen Molekülen herrühren, die die Stammzellen freisetzen. Lesen Sie hier mehr über das Stammzellsekretom und seine Wirkweise.
Was kostet eine Stammzelltherapie?
In Nordamerika gibt es viele Kliniken, die für Stammzelltherapie werben. Einige ihrer Behandlungen können Sie auf USD 4.000 bis USD 7.000 beziffern.
Ein Bericht der amerikanischen Medienagentur PBS besagt, dass systemische Behandlungen in einigen Kliniken USD 20.000 bis USD 30.000 kosten können. Beispiele für Krankheiten, die diese Art der Behandlung erfordern, umfassen:
- Morbus Crohn
- Multiple Sklerose
- Neurodegenerative Erkrankungen wie Alzheimer und Demenz
- Psoriasis oder rheumatoide Arthritis
Trotz dieser Kosten probieren viele Menschen in den USA oder Kanada sie immer noch aus, da sie vergleichsweise billiger sind als Behandlungen in Europa. Einige dieser Kliniken wurden jedoch bereits häufiger durch die örtliche Behörde (Food and Drug Administration, FDA) aus compliance- und ethischen Gründen ermahnt.
Bevor Sie mit einer Stammzellbehandlung beginnen, sollten Sie daher die Klinik, ihre Verfahren und Prozesse und deren Qualitätszustand näher betrachten. Hohe Sicherheits- und Qualitätsstandards sind unter Umständen die höheren Kosten wert.
Was kostet eine Stammzellinjektion?
Die Preise variieren je nach Art der Stammzellen, Art der Gewebequelle, Art der Behandlung und Land. Es gibt Kliniken in den USA und Kanada, die Berichten zufolge für eine Stammzelleninjektion 5.000 USD in Rechnung stellen.
Wir bei ANOVA betrachten eine Injektion nur als Teil des gesamten Therapieprogramms. Wir streben nach dauerhaften Ergebnissen, und dies kann nur erreicht werden, wenn wir die Behandlung auf sichere und ganzheitliche Weise betrachten. Nehmen Sie Kontakt mit uns auf, damit wir Ihnen einen Kostenvoranschlag für eine Therapie bei ANOVA zukommen lassen können.
Welche Krankheiten können Stammzellen behandeln?
Die Behandlung mittels Stammzellen ist kein Allheilmittel, aber es gibt viele Studien, die ihre Wirksamkeit bei bestimmten Krankheiten belegen:
Schlaganfall und Herzerkrankungen
Für viele Überlebende eines Schlaganfalls ist Thrombolyse oder die Auflösung des Blutgerinnsels die einzige verfügbare Therapieoption. Dank der Fortschritte in der Stammzellforschung kann die Stammzelltherapie eine alternative Behandlungsmöglichkeit für Schlaganfallpatienten sein.
Parkinson-Krankheit
Es ist bedauerlich, dass die Parkinson-Krankheit, von der Millionen Menschen auf der ganzen Welt betroffen sind, derzeit kein Heilmittel kennt. Was viele Therapien tun, ist einfach die Symptome zu unterdrücken, zum Beispiel durch Hormonersatztherapien. Leider stoppt dies nicht die neurale Degeneration oder ersetzt tote Gehirnzellen. Laut kürzlich durchgeführten klinischen Studien mit ermutigenden Ergebnissen kann die Behandlung mittels MSCs eine alternative für Parkinson-Patienten sein.
Erektionsstörungen und Impotenz
Männer jeden Alters können von erektiler Dysfunktion und verminderter Potenz betroffen sein, die häufig mit Diabetes und Bluthochdruck verbunden sind. Es gibt zwar viele Pillen oder alternative Behandlungen, die zur „Heilung“ dieser Zustände angeboten werden, sie können jedoch nur vorübergehend wirken und die Grundursache des Problems nicht beheben. Stammzellbasierte Therapien sind zur Alternative geworden, aber es sind noch weitere Studien notwendig, um die Wirksamkeit genau beurteilen zu können.
Arthrose
Als weltweit häufigste Ursache für Schmerzen hält die Arthrose viele Menschen auf der ganzen Welt davon ab, ein mobiles und dynamisches Leben zu führen. Neue evidenzbasierte Untersuchungen haben gezeigt, dass stammzellbasierte Therapien im Vergleich zu Standardmedikamenten, die nur die Symptome maskieren, länger anhaltende Wirkungen haben.
Knieverletzungen
Menschen mit Knieverletzungen haben möglicherweise das Gefühl, nur sehr begrenzte Therapiemöglichkeiten zu haben. Es gibt jedoch eine Möglichkeit für sie, schneller zu ihrem aktiven Lebensstil zurückzukehren, ohne den Aufwand und Risiken einer Operation. Es gibt klinische Belege dafür, wie zellbasierte Therapien den Heilungsprozess bei Knieverletzungen verbessern können. In einigen Fällen kann eine Operation erforderlich sein, die Kombination mit den Therapien wird jedoch als sichere Therapieoption angesehen.
Rückenschmerzen und Wirbelsäulenverletzungen
Meistens werden Rückenschmerzen und Probleme mit der Wirbelsäule mit invasiven und riskanten Methoden wie Operationen behandelt. Andere verlassen sich einfach auf Schmerzmittel. Es mag wie ein einfaches Problem erscheinen, aber es betrifft die Betroffenen in allen Lebensbereichen. Aus diesem Grund ist eine langfristige Lösung notwendig, die die Ursache dieser Zustände auf zellulärer Ebene angeht. Hier kommt die Stammzelltherapie ins Spiel, die sich bei der Bekämpfung von Schmerzen und Wirbelsäulendegenerationen laut einiger Studien als wirksam erwiesen hat. Trotzdem bleibt die Stammzelltherapie eine experimentelle Behandlung.
ALS - Amyotrophe Lateralsklerose
ALS wird nach einem beliebten Baseballspieler mit derselben Erkrankung auch als Lou-Gehrig-Krankheit bezeichnet und ist aufgrund des Verlusts der Nervenstimulation durch eine schwere motorische Dysfunktion gekennzeichnet. Es gibt Studien, die implizieren, dass die Stammzelltherapie ein vielversprechender neuer Ansatz zum Schutz der Motoneuronen von ALS-Patienten sein kann. Auch hier sind noch weitere klinische Studien erforderlich, um die Wirksamkeit abschließend bewerten zu können.
RA - Rheumatoide Arthritis
Rheumatoide Arthritis (RA) ist eine Autoimmunerkrankung, für die keine Heilung verfügbar ist. Die neuesten stammzellbasierten Therapien können die Probleme jedoch auf drei Arten angehen: Sie können Entzündungen stoppen, die Immunantworten modulieren und Gewebe regenerieren. Zu den Formen der Arthritis, die davon profitieren können, gehören Psoriasis-Arthritis, juvenile idiopathische Arthritisund Gicht.
MS - Multiple Sklerose
Medikamente gegen Multiple Sklerose versuchen, das Fortschreiten der Krankheit zu verlangsamen, aber mehr können sie nicht tun. Patienten mit MS haben die Möglichkeit, sich Stammzelltherapien zuzuwenden, die im Rahmen einer experimentellen Therapie das Potential haben, die Regeneration geschädigter Gehirnzellen zu stimulieren oder zumindest das Fortschreiten der Krankheit zu verlangsamen.
Anti-Aging
Warum ist die Stammzelltherapie bei so vielen Anti-Aging-Produkten auf dem Markt eine Alternative? Einfach, weil Stammzellen in der Lage sind, Gewebe auf zellulärer Ebene zu regenerieren. Genauer gesagt können Stammzellen die Funktionen des Körpers nicht nur an der Oberfläche, sondern auch von innen wiederbeleben.
Was sind die Nebenwirkungen der Stammzelltherapie?
Bei jeder Art der Behandlung können Nebenwirkungen auftreten. Man kann nie zu 100% Nebenwirkungen ausschließen. Die Wahrscheinlichkeit und Schwere von Nebenwirkungen von Stammzelltherapien hängt sehr stark vom Zustand des Patienten, der spezifischen Art der Behandlung und der behandelten Krankheit ab.
Autologe Therapieansätze scheinen grundsätzlich ein geringeres Risiko zu haben als Therapien wie die Stammzelltransplantation. Auch konnten einige Studien zeigen, dass zellfreie Therapien (wie z.B. die Sekretomtherapie) mit geringeren Nebenwirkungen assoziiert wurde als Stammzellinjektionen.
Aus diesem Grund stellen wir bei ANOVA sicher, dass wir jeden Patienten gründlich untersuchen und eine Risko-Nutzen-Analyse durchführen um unsere Therapie auf seine speziellen Bedürfnisse zuschneiden und Risiken wie Nebenwirkungen zu minimieren.
Stammzelltherapien der ANOVA IRM in Offenbach
Knochenmarkkonzentrat (BMC) und mesenchymale Stammzellen (MSCs) sind die am häufigsten vorkommende Form autologer adulter Stammzellen, die für die klinische Anwendung gut geeignet sind. Sie können relativ leicht, schnell und schmerzfrei aus dem Knochenmark (BMC) oder aus dem subkutanen ("unter der Haut") Fett (MSC) gewonnen werden.
Derzeit bietet ANOVA hauptsächlich die BMC-Therapie an, die in Form einer Stammzellinjektion appliziert wird. Wir bieten auch Kombinationstherapien mit Plättchenreichem Plasma (PRP) und Hyaluronsäure (HA, hyaluronic acid) an, einem Medium, das reich an Wachstumsfaktoren und anderen Zytokinen (Molekülen des Immunsystems) ist, die die Heilung stimulieren. Auch bietet die ANOVA in Einzelfällen das zellfreie Stammzellsekretom an, bei dem, wie der Name schon sagt, das Sekretom der Stammzellen appliziert wird. Grundsätzlich können diese Therapien miteinander kombiniert werden, da sie nahtlos zusammenwirken.
ANOVA bietet individualisierte und stets autologe Stammzelltherapien mit adulten Stammzellen (s.u.) an, die für den jeweiligen Zustand des Patienten und nur für den Patienten am besten geeignet sind. Die Anwendung dieser Therapien hängt vollständig vom Gesundheitszustand des Patienten ab.
Weiterführende Literatur zu MSC, BMC, Stamzellen Secretom und EVs
- Georg Hansmann, Philippe Chouvarine, Franziska Diekmann, Martin Giera, Markus Ralser, Michael Mülleder, Constantin von Kaisenberg, Harald Bertram, Ekaterina Legchenko & Ralf Hass "Human umbilical cord mesenchymal stem cell-derived treatment of severe pulmonary arterial hypertension". Nature Cardiovascular Research volume 1, pages568–576 (2022).
- Murphy JM, Fink DJ, Hunziker EB, et al. Stem cell therapy in a caprine model of osteoarthritis . Arthritis Rheum. 2003;48:3464–74.
- Lee KB, Hui JH, Song IC, Ardany L, et al. Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model. Stem Cell. 2007;25:2964–71.
- Saw KY, Hussin P, Loke SC, et al. Articular cartilage regeneration with autologous marrow aspirate and hyaluronic acid: an experimental study in a goat model. Arthroscopy . 2009;25(12):1391–400.
- Black L, Gaynor J, Adams C, et al. Effect of intra-articular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Vet Ther. 2008;9:192-200.
- Centeno C, Busse D, Kisiday J, et al. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells. Pain Physician. 2008;11(3):343–53.
- Centeno C, Kisiday J, Freeman M, et al. Partial regeneration of the human hip via autologous bone marrow nucleated cell transfer: a case study. Pain Physician. 2006;9:253–6.
- Centeno C, Schultz J, Cheever M. Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique. Curr Stem Cell. 2011;5(1):81–93.
- Pak J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose derived stem cells: a case series. J Med Case Rep. 2001;5:296.
- Kuroda R, Ishida K, et al. Treatment of a full-thickness articular cartilage defect in the femoral condyle of an athlete with autologous bone-marrow stromal cells. Osteoarthritis Cartilage. 2007;15:226–31.
- Emadedin M, Aghdami N, Taghiyar L, et al. Intra-articular injection of autologous mesenchymal stem cells in six patients with knee osteoarthritis. Arch Iran Med. 2012;15(7):422–8.
- Saw KY et al. Articular cartilage regeneration with autologous peripheral blood stem cells versus hyaluronic acid: a randomized controlled trial. Arthroscopy. 2013;29(4):684–94.
- Vangsness CT, Farr J, Boyd J, et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy. J Bone Joint Surg. 2014;96(2):90–8.
- Freitag, Julien, et al. Mesenchymal stem cell therapy in the treatment of osteoarthritis: reparative pathways, safety and efficacy–a review. BMC musculoskeletal disorders 17.1 (2016): 230.
- Maumus, Marie, Christian Jorgensen, and Danièle Noël. " Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. " Biochimie 95.12 (2013): 2229-2234.
- Dostert, Gabriel, et al. " How do mesenchymal stem cells influence or are influenced by microenvironment through extracellular vesicles communication?. " Frontiers in Cell and Developmental Biology 5 (2017).
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- Toh, Wei Seong, et al. " MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. " Seminars in Cell & Developmental Biology. Academic Press, 2016.
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- S. Koelling, J. Kruegel, M. Irmer, J.R. Path, B. Sadowski, X. Miro, et al., Migratory chondrogenic progenitor cells from repair tissue during the later stages of human osteoarthritis , Cell Stem Cell 4 (2009) 324–335.
- B.A. Jones, M. Pei, Synovium-Derived stem cells: a tissue-Specific stem cell for cartilage engineering and regeneration , Tissue Eng. B: Rev. 18 (2012) 301–311.
- W. Ando, J.J. Kutcher, R. Krawetz, A. Sen, N. Nakamura, C.B. Frank, et al., Clonal analysis of synovial fluid stem cells to characterize and identify stable mesenchymal stromal cell/mesenchymal progenitor cell phenotypes in a porcine model: a cell source with enhanced commitment to the chondrogenic lineage, Cytotherapy 16 (2014) 776–788.
- K.B.L. Lee, J.H.P. Hui, I.C. Song, L. Ardany, E.H. Lee, Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model, Stem Cells 25 (2007) 2964–2971.
- W.-L. Fu, C.-Y. Zhou, J.-K. Yu, A new source of mesenchymal stem cells for articular cartilage repair: mSCs derived from mobilized peripheral blood share similar biological characteristics in vitro and chondrogenesis in vivo as MSCs from bone marrow in a rabbit model , Am. J. Sports Med. 42 (2014) 592–601.
- X. Xie, Y. Wang, C. Zhao, S. Guo, S. Liu, W. Jia, et al., Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration , Biomaterials 33 (2012) 7008–7018.
- E.-R. Chiang, H.-L. Ma, J.-P. Wang, C.-L. Liu, T.-H. Chen, S.-C. Hung, Allogeneic mesenchymal stem cells in combination with hyaluronic acid for the treatment of osteoarthritis in rabbits , PLoS One 11 (2016) e0149835.
- H. Nejadnik, J.H. Hui, E.P. Feng Choong, B.-C. Tai, E.H. Lee, Autologous bone marrow–derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study , Am. J. Sports Med. 38 (2010) 1110–1116.
- I. Sekiya, T. Muneta, M. Horie, H. Koga, Arthroscopic transplantation of synovial stem cells improves clinical outcomes in knees with cartilage defects , Clin. Orthop. Rel. Res. 473 (2015) 2316–2326.
- Y.S. Kim, Y.J. Choi, Y.G. Koh, Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors influencing clinical outcomes , Am. J. Sports Med. 43 (2015) 2293–2301.
- W.-L. Fu, Y.-F. Ao, X.-Y. Ke, Z.-Z. Zheng, X. Gong, D. Jiang, et al., Repair of large full-thickness cartilage defect by activating endogenous peripheral blood stem cells and autologous periosteum flap transplantation combined with patellofemoral realignment , Knee 21 (2014) 609–612.
- Y.-G. Koh, O.-R. Kwon, Y.-S. Kim, Y.-J. Choi, D.-H. Tak, Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial , Arthrosc. J. Arthrosc. Relat. Surg. 32 (2016) 97–109.
- T.S. de Windt, L.A. Vonk, I.C.M. Slaper-Cortenbach, M.P.H. van den Broek, R. Nizak, M.H.P. van Rijen, et al., Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-Stage cartilage repair in humans upon mixture with recycled autologous chondrons , Stem Cells (2016) (n/a-n/a).
- L. da Silva Meirelles, A.M. Fontes, D.T. Covas, A.I. Caplan, Mechanisms involved in the therapeutic properties of mesenchymal stem cells , Cytokine Growth Factor Rev. 20 (2009) 419–427.
- W.S. Toh, C.B. Foldager, M. Pei, J.H.P. Hui, Advances in mesenchymal stem cell-based strategies for cartilage repair and regeneration , Stem Cell Rev. Rep. 10 (2014) 686–696.
- R.C. Lai, F. Arslan, M.M. Lee, N.S.K. Sze, A. Choo, T.S. Chen, et al., Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury , Stem Cell Res. 4 (2010) 214–222.
- S. Zhang, W.C. Chu, R.C. Lai, S.K. Lim, J.H.P. Hui, W.S. Toh, Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration, Osteoarthr . Cartil. 24 (2016) 2135–2140.
- S. Zhang, W. Chu, R. Lai, J. Hui, E. Lee, S. Lim, et al., 21 – human mesenchymal stem cell-derived exosomes promote orderly cartilage regeneration in an immunocompetent rat osteochondral defect model , Cytotherapy 18 (2016) S13.
- C.T. Lim, X. Ren, M.H. Afizah, S. Tarigan-Panjaitan, Z. Yang, Y. Wu, et al., Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol) fumarate] hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model
- A. Gobbi, G. Karnatzikos, S.R. Sankineani, One-step surgery with multipotent stem cells for the treatment of large full-thickness chondral defects of the knee , Am. J. Sports Med. 42 (2014) 648–657.
- A. Gobbi, C. Scotti, G. Karnatzikos, A. Mudhigere, M. Castro, G.M. Peretti, One-step surgery with multipotent stem cells and Hyaluronan-based scaffold for the treatment of full-thickness chondral defects of the knee in patients older than 45 years , Knee Surg. Sports Traumatol. Arthrosc. (2016) 1–8.
- A. Gobbi, G. Karnatzikos, C. Scotti, V. Mahajan, L. Mazzucco, B. Grigolo, One-step cartilage repair with bone marrow aspirate concentrated cells and collagen matrix in full-thickness knee cartilage lesions: results at 2-Year follow-up , Cartilage 2 (2011) 286–299.
- K.L. Wong, K.B.L. Lee, B.C. Tai, P. Law, E.H. Lee, J.H.P. Hui, Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years’ follow-up , Arthrosc. J. Arthrosc. Relat. Surg. 29 (2013) 2020–2028.
- J.M. Hare, J.E. Fishman, G. Gerstenblith, et al., Comparison of allogeneic vs autologous bone marrow–derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy: the poseidon randomized trial, JAMA 308 (2012) 2369–2379.
- L. Wu, J.C.H. Leijten, N. Georgi, J.N. Post, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells increase chondrocyte proliferation and matrix formation , Tissue Eng. A 17 (2011) 1425–1436.
- L. Wu, H.-J. Prins, M.N. Helder, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells in chondrocyte Co-Cultures are independent of culture conditions and cell sources , Tissue Eng. A 18 (2012) 1542–1551.
- S.K. Sze, D.P.V. de Kleijn, R.C. Lai, E. Khia Way Tan, H. Zhao, K.S. Yeo, et al., Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells , Mol. Cell. Proteomics 6 (2007) 1680–1689.
- M.B. Murphy, K. Moncivais, A.I. Caplan, Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine , Exp. Mol. Med. 45 (2013) e54.
- M.J. Lee, J. Kim, M.Y. Kim, Y.-S. Bae, S.H. Ryu, T.G. Lee, et al., Proteomic analysis of tumor necrosis factor--induced secretome of human adipose tissue-derived mesenchymal stem cells , J. Proteome Res. 9 (2010) 1754–1762.
- S. Bruno, C. Grange, M.C. Deregibus, R.A. Calogero, S. Saviozzi, F. Collino, et al., Mesenchymal stem cell-derived microvesicles protect against acute tubular injury, J. Am. Soc. Nephrol. 20 (2009) 1053–1067.
- M. Yá˜nez-Mó, P.R.-M. Siljander, Z. Andreu, A.B. Zavec, F.E. Borràs, E.I. Buzas, et al. Biological properties of extracellular vesicles and their physiological functions (2015).
- C. Lawson, J.M. Vicencio, D.M. Yellon, S.M. Davidson, Microvesicles and exosomes: new players in metabolic and cardiovascular disease , J. Endocrinol. 228 (2016) R57–R71.
- A.G. Thompson, E. Gray, S.M. Heman-Ackah, I. Mager, K. Talbot, S.E. Andaloussi, et al., Extracellular vesicles in neurodegenerative diseas—pathogenesis to biomarkers, Nat. Rev. Neurol. 12 (2016) 346–357.
- I.E.M. Bank, L. Timmers, C.M. Gijsberts, Y.-N. Zhang, A. Mosterd, J.-W. Wang, et al., The diagnostic and prognostic potential of plasma extracellular vesicles for cardiovascular disease , Expert Rev. Mol. Diagn. 15 (2015) 1577–1588.
- T. Kato, S. Miyaki, H. Ishitobi, Y. Nakamura, T. Nakasa, M.K. Lotz, et al., Exosomes from IL-1 stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes , Arthritis. Res. Ther. 16 (2014) 1–11.
- R.W.Y. Yeo, S.K. Lim, Exosomes and their therapeutic applications, in: C. Gunther, A. Hauser, R. Huss (Eds.), Advances in Pharmaceutical Cell TherapyPrinciples of Cell-Based Biopharmaceuticals, World Scientific, Singapore, 2015, pp. 477–491.
- X. Qi, J. Zhang, H. Yuan, Z. Xu, Q. Li, X. Niu, et al., Exosomes secreted by human-Induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats , Int. J. Biol. Sci. 12 (2016) 836–849.
- R.C. Lai, F. Arslan, S.S. Tan, B. Tan, A. Choo, M.M. Lee, et al., Derivation and characterization of human fetal MSCs: an alternative cell source for large-scale production of cardioprotective microparticles , J. Mol. Cell. Cardiol. 48 (2010) 1215–1224.
- Y. Zhou, H. Xu, W. Xu, B. Wang, H. Wu, Y. Tao, et al., Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro , Stem Cell Res. Ther. 4 (2013) 1–13.
- Y. Qin, L. Wang, Z. Gao, G. Chen, C. Zhang, Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo , Sci. Rep. 6 (2016) 21961.
- M. Nakano, K. Nagaishi, N. Konari, Y. Saito, T. Chikenji, Y. Mizue, et al., Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes , Sci. Rep. 6 (2016) 24805.
- K. Nagaishi, Y. Mizue, T. Chikenji, M. Otani, M. Nakano, N. Konari, et al., Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes , Sci. Rep. 6 (2016) 34842.
- S.R. Baglio, K. Rooijers, D. Koppers-Lalic, F.J. Verweij, M. Pérez Lanzón, N. Zini, et al., Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species , Stem Cell Res. Ther. 6 (2015) 1–20.
- T. Chen, R. Yeo, F. Arslan, Y. Yin, S. Tan, Efficiency of exosome production correlates inversely with the developmental maturity of MSC donor, J. Stem Cell Res. Ther. 3 (2013) 2.
- R.C. Lai, S.S. Tan, B.J. Teh, S.K. Sze, F. Arslan, D.P. de Kleijn, et al., Proteolytic potential of the MSC exosome proteome: implications for an exosome-mediated delivery of therapeutic proteasome , Int. J. Proteomics 2012 (2012) 971907.
- T.S. Chen, R.C. Lai, M.M. Lee, A.B.H. Choo, C.N. Lee, S.K. Lim, Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs , Nucleic Acids Res. 38 (2010) 215–224.
- R.W. Yeo, R.C. Lai, K.H. Tan, S.K. Lim, Exosome: a novel and safer therapeutic refinement of mesenchymal stem cell, J. Circ. Biomark. 1 (2013) 7.
- R.C. Lai, R.W. Yeo, S.K. Lim, Mesenchymal stem cell exosomes, Semin. Cell Dev. Biol. 40 (2015) 82–88.
- B. Zhang, R.W. Yeo, K.H. Tan, S.K. Lim, Focus on extracellular vesicles: therapeutic potential of stem cell-derived extracellular vesicles , Int. J. Mol. Sci. 17 (2016) 174.
- Hu G-w, Q. Li, X. Niu, B. Hu, J. Liu, Zhou S-m, et al., Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice , Stem Cell Res. Ther. 6 (2015) 1–15.
- J. Zhang, J. Guan, X. Niu, G. Hu, S. Guo, Q. Li, et al., Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis , J. Transl. Med. 13 (2015) 1–14.
- B. Zhang, M. Wang, A. Gong, X. Zhang, X. Wu, Y. Zhu, et al., HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing, Stem Cells 33 (2015) 2158–2168.
- B. Zhang, Y. Yin, R.C. Lai, S.S. Tan, A.B.H. Choo, S.K. Lim, Mesenchymal stem cells secrete immunologically active exosomes , Stem Cells Dev. 23 (2013) 1233–1244.
- C.Y. Tan, R.C. Lai, W. Wong, Y.Y. Dan, S.-K. Lim, H.K. Ho, Mesenchymal stem cell-derived exosomes promote hepatic regeneration in drug-induced liver injury models , Stem Cell Res. Ther. 5 (2014) 1–14.
- C. Lee, S.A. Mitsialis, M. Aslam, S.H. Vitali, E. Vergadi, G. Konstantinou, et al., Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension , Circulation 126 (2012) 2601–2611.
- B. Yu, H. Shao, C. Su, Y. Jiang, X. Chen, L. Bai, et al., Exosomes derived from MSCs ameliorate retinal laser injury partially by inhibition of MCP-1 , Sci. Rep. 6 (2016) 34562.
- Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof of concept clinical trial. Stem Cells. 2014;32(5):1254–66.
- Vega, Aurelio, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681–90.
- Davatchi F, Sadeghi-Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis. Preliminary report of four patients. Int J Rheum Dis. 2011;14(2):211–5
- Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case- controlled study. Int Orthop. 2014;38(9):1811–1818
- Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives. Biomed Res Int. 2014;2014:6.
- Beitzel K, Solovyova O, Cote MP, et al. The future role of mesenchymal Stem cells in The management of shoulder disorders . Arthroscopy. 2013;29(10):1702–1711.
- Isaac C, Gharaibeh B, Witt M, Wright VJ, Huard J. Biologic approaches to enhance rotator cuff healing after injury. J Shoulder Elbow Surg. 2012;21(2):181–190.
- Malda, Jos, et al. " Extracellular vesicles [mdash] new tool for joint repair and regeneration. " Nature Reviews Rheumatology (2016).
Weiterführende Literatur zu PRP
- Rubio-Azpeitia E, Andia I. Partnership between platelet-rich plasma and mesenchymal stem cells: in vitro experience. Muscles Ligaments Tendons J. 2014;4(1):52–62.
Extras
- Xu, Ming, et al. " Transplanted senescent cells induce an osteoarthritis-like condition in mice. " The Journals of Gerontology Series A: Biological Sciences and Medical Sciences (2016): glw154.
- McCulloch, Kendal, Gary J. Litherland, and Taranjit Singh Rai. " Cellular senescence in osteoarthritis pathology ." Aging Cell (2017).
Patienten-Services des ANOVA Institute for Regenerative Medicine
- Das Institut liegt in Offenbach am Main, im Herzen Deutschlands, weniger als 20 Minuten vom Frankfurter Flughafen entfernt
- Individualisierte Therapie mit innovativen Stammzellprodukten
- Individuell geplante diagnostische Untersuchungen mit modernen MR- und CT-Geräten und Blutuntersuchungen
- Deutscher Qualitätsstandard (100% made in Germany) für Produktsicherheit und Qualitätssicherung
- Persönlicher Service mit freundlichen, engagierten Patientenbetreuern und Krankenschwestern
- Stetiger wissenschaftlicher Austausch mit akademischen Einrichtungen, um Ihnen die innovativsten Behandlungen im Bereich regenerative Medizin anbieten zu können