Rückenmarksverletzungen
Mit REMCell-Behandlung vom Rollstuhl wieder zum Gehen
Neue Horizonte: Kombinieren Sie Robotik und ANOVA IRM stammzellenbasierte Behandlungen
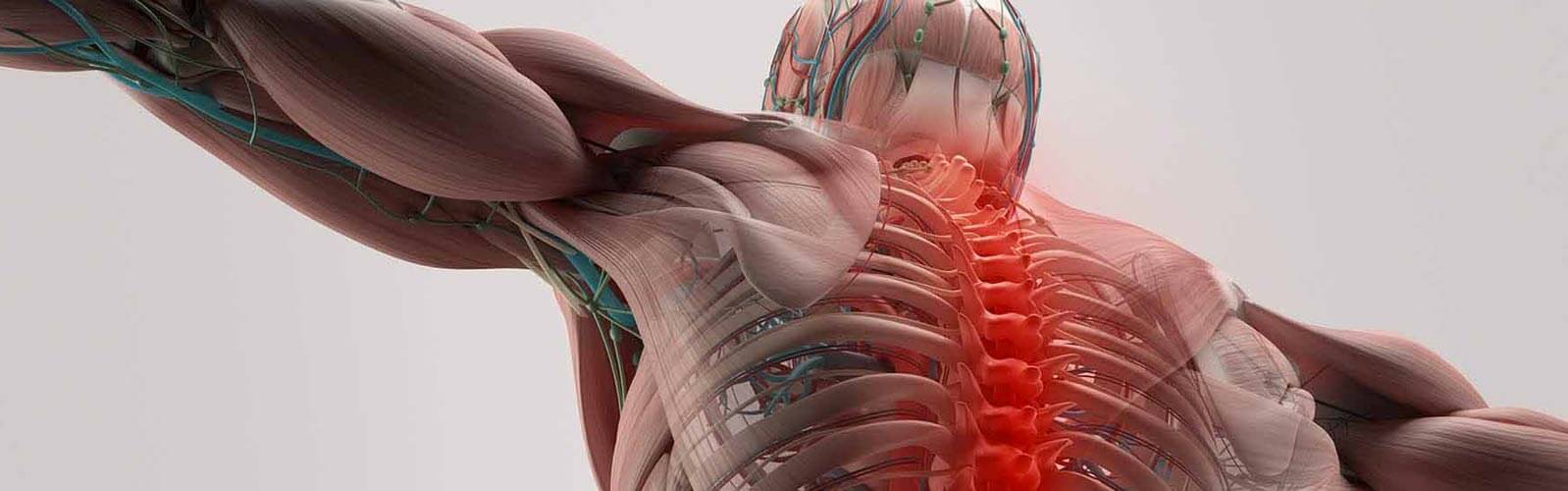
Das Rückenmark ist eine Säule aus Nervengewebe, die das Gehirn mit den peripheren Nerven verbindet. Eine Schädigung des Rückenmarks durch ein Trauma oder auf andere Weise hat schwere motorische und sensorische Defizite zur Folge, die in der Regel zur Bewegungs- und Gefühlsunfähigkeit führen. Unfälle sind die häufigste Ursache für Rückenmarksverletzungen, die katastrophale Folgen für das Leben der Patienten und ihrer Angehörigen haben. Während konservative Therapien darauf abzielen, den Patienten zu stabilisieren, ist die funktionelle Erholung in den meisten Fällen minimal.
Jetzt gibt es neue Hoffnung für Patienten mit Lähmungen infolge von Rückenmarksverletzungen. Die Kombination von mesenchymaler Stammzellen-basierter Neuro-Regeneration mit neurofunktionellem Roboter-Exoskelett-Training - die REMCell-Behandlung - gibt Hoffnung, aus dem Rollstuhl herauszukommen und wieder zu gehen.
Ermöglicht wird dies durch eine einzigartige Zusammenarbeit zwischen dem ANOVA Institut für Regenerative Medizin in Offenbach und Cyberdyne, einem japanischen Unternehmen mit einem Trainingszentrum in Bochum, Deutschland.
Seit 2019 kooperieren wir mit Cyberdyne Care Robotics, wobei ANOVA die erste Einrichtung weltweit ist, die eine behördliche Genehmigung für die Herstellung und Behandlung mit mesenchymalen Stammzellsekretomen erhalten hat, Cyberdyne hat das HAL-Exoskelett für das neurofunktionelle Feedbacktraining entwickelt.
Die REMCell-Behandlung, die erste Kombination aus Neuro-Regeneration mit Stammzellen und dem neurofunktionellen Training mit dem HAL-Exoskelett, verspricht, viele gelähmte Patienten aus dem Rollstuhl zu holen - und bringt die Neuro-Rehabilitation ins 21. sJahrhundert.
Jetzt gibt es neue Hoffnung für Patienten mit Lähmungen infolge von Rückenmarksverletzungen. Die Kombination von mesenchymaler Stammzellen-basierter Neuro-Regeneration mit neurofunktionellem Roboter-Exoskelett-Training - die REMCell-Behandlung - gibt Hoffnung, aus dem Rollstuhl herauszukommen und wieder zu gehen.
Ermöglicht wird dies durch eine einzigartige Zusammenarbeit zwischen dem ANOVA Institut für Regenerative Medizin in Offenbach und Cyberdyne, einem japanischen Unternehmen mit einem Trainingszentrum in Bochum, Deutschland.
Seit 2019 kooperieren wir mit Cyberdyne Care Robotics, wobei ANOVA die erste Einrichtung weltweit ist, die eine behördliche Genehmigung für die Herstellung und Behandlung mit mesenchymalen Stammzellsekretomen erhalten hat, Cyberdyne hat das HAL-Exoskelett für das neurofunktionelle Feedbacktraining entwickelt.
Die REMCell-Behandlung, die erste Kombination aus Neuro-Regeneration mit Stammzellen und dem neurofunktionellen Training mit dem HAL-Exoskelett, verspricht, viele gelähmte Patienten aus dem Rollstuhl zu holen - und bringt die Neuro-Rehabilitation ins 21. sJahrhundert.
Diagnostik und Stammzellbehandlungen
bei Rückenmarksverletzungen
Hier finden Sie Informationen über Rückenmarksverletzungen (komplette und inkomplette, partielle Rückenmarksverletzungen) mit einem Überblick über wichtige Aspekte der Behandlungsmöglichkeiten, der Präzisionsdiagnostik, die die Schmerzursache und den Ort des schmerzverursachenden Defekts aufdeckt, sowie über unsere stammzellbasierten Therapien, die wir in Offenbach (bei Frankfurt/Main) anbieten und die HAL-Exoskelett-Therapie, die wir bei SCI (Spinal cord injury) empfehlen.
Springen Sie direkt zu folgenden Themen:
- Konventionelle Therapien
- ANOVA-Therapien bei Rückenmarksverletzungen
- Erwartungen und Grenzen
- Unsere Rückenmarksverletzungstherapie mit MSEC
- Empfohlenes Exoskelett-Trainingsprogramm
- Ablauf des Behandlungsprozesses nur mit Stammzellen
- Ablauf des Behandlungsprozesses mit REMCell
- Diagnostik der schmerzverursachenden Defekte
- Der ANOVA-Unterschied: gezielte Behandlung
- Sie möchten eine zweite Meinung einholen
- Quellen und Literatur
Wir behandeln die folgenden Verletzungen und Erkrankungen:
- Partielle Rückenmarksverletzungen (cervikal, thorakal und lumbal)
- Unvollständige Rückenmarksverletzungen (cervikal, thorakal und lumbal)
- Rückenmarkskompression (cervikal, thorakal und lumbal)
- Rückenmarksödeme nach Operationen (cervikal, thorakal und lumbal)
- Vollständige Rückenmarksverletzung in einigen Fällen (reaktionsfähig, cervikal, thorakal und lumbal)
Allgemein verfügbare konventionelle Therapien
Sind die derzeitigen Konzepte der Neuro-Rehabilitation veraltet?
Bislang ging man davon aus, dass die Patienten nach Rückenmarksverletzungen drei kritische Phasen durchlaufen: Die akute, subakute und chronische Phase. In der chronischen Phase, die ein Jahr nach der Schädel-Hirn-Verletzung beginnt, wurde angenommen, dass eine weitere funktionelle Erholung nicht möglich ist. Es wurde auch angenommen, dass das Hauptproblem bei Patienten mit Rückenmarkverletzungen auf der Ebene des verletzten Rückenmarks liegt. Beide Annahmen haben sich inzwischen als falsch erwiesen, zumindest teilweise.
Die falschen Vorstellungen und das mangelnde Verständnis der tatsächlichen Pathomechanismen von SCI sind für die Unwirksamkeit der meisten derzeit angewandten Neuro-Rehabilitationsbehandlungen verantwortlich, die hauptsächlich darauf abzielen, den Zustand des Patienten zu stabilisieren, nicht aber auf die Wiederherstellung der Funktion. Dies gilt vor allem für die subakute und chronische Phase.
Leider wird auch bei der Behandlung in der akuten Phase nicht immer die Pathophysiologie der Schädel-Hirn-Verletzung berücksichtigt. Im Falle einer lokalen Schädigung, z. B. durch einen gebrochenen Wirbel, der eine mechanische Beschädigung verursacht, kann die sekundäre Schädigung, die durch eine ödematöse Schwellung des Rückenmarks verursacht wird, das Ergebnis erheblich verschlechtern. Eine Schädigung des Rückenmarks führt zu Blutungen und Entzündungen mit der daraus resultierenden Ansammlung von Flüssigkeit im Rückenmark (Hämatom und Ödem). Dies lässt das Rückenmark anschwellen. In einem begrenzten Raum wie dem Wirbelkanal kann sich das geschwollene Rückenmark nicht ausreichend ausdehnen. Die Schwellung führt dann zu einem Druckanstieg im Rückenmark, der die Blutgefäße zusammendrückt und zu einer mangelnden Blutzufuhr führt, wodurch sich der Bereich der Schädigung deutlich vergrößert. Eine frühzeitige aggressive Behandlung, sowohl chirurgisch als auch medikamentös, kann diese Sekundärschäden begrenzen, indem die Schwellung reduziert und der Blutdruck kontrolliert wird. Bei unsachgemäßer Anwendung kann dies zu unnötigen zusätzlichen Funktionseinbußen für den Patienten führen.
Sowohl externe präklinische als auch externe klinische Studien haben gezeigt, dass sich die Genesung von SCI-Patienten verbessert, wenn die Therapie mit einer geeigneten Stammzelltherapie kombiniert wird. Mit dem Stammzellsekretom von ANOVA bieten wir Zugang zu der fortschrittlichsten klinisch verfügbaren Kombination von behördlich kontrollierten stammzellbasierten Therapien für die Behandlung von SCI.
Stammzell-Behandlungen für Rückenmarksverletzungen
ANOVA Institue for Regenerative Medicine in Offenbach, Deutschland
BMC, Sekretom/Exosomen, PRP
Welche therapeutischen Erfolge sind zu erwarten?
Während sich das HAL-Exoskelett-Training an sich bereits als wesentlich effektiver erwiesen hat als herkömmliches Neuro-Rehabilitationstraining, verspricht die Kombination mit stammzellbasierter Neuro-Regeneration noch bessere Ergebnisse. Externe präklinische Studien zur Wirkung von mesenchymalen Stammzellen und ihrem Sekretom haben zahlreiche positive Effekte auf das geschädigte Rückenmarksgewebe gezeigt, wie die Reorganisation von Glia-Narben, eine verbesserte Vaskularisierung und die Förderung des axonalen Wachstums.
Was das HAL-Exoskelett betrifft, so haben Untersuchungen gezeigt, dass das neurofunktionelle Training die Unabhängigkeit der Patienten, insbesondere ihre Gehfähigkeit, erheblich verbessert. Für viele Patienten, die zuvor an den Rollstuhl gefesselt waren, wurde das Gehen mit einem Rollator, mit Krücken oder ohne Krücken möglich.
Aber es gibt noch weitere Vorteile: Die Patienten erlebten einen Rückgang der neuropathischen Schmerzen, positive Veränderungen der Spastizität, eine verbesserte Sensibilität und infolgedessen ein geringeres Risiko von Druckgeschwüren. Nach Abschluss der neuro-muskulären Feedback-Therapie bleiben die erzielten Erfolge erhalten, solange die Patienten ihre wiedergewonnene Mobilität aktiv im Alltag nutzen, d.h. aus dem Rollstuhl aufstehen und mit einem Rollator oder mit Krücken gehen.
Potenzhypothese der Stammzelltherapien
Stammzellen besitzen das Potenzial, mit den entzündungsauslösenden Immunzellen zu kommunizieren und durch natürliche, bisher nicht verstandene Mechanismen diese Immunüberreaktion zu hemmen. Nachdem sie die Entzündungsreaktion in geschädigten Bereichen gestoppt haben, können Stammzellen die Regeneration von Gewebe anregen. Negative Langzeitwirkungen ähnlich wie bei Kortison sind nicht zu erwarten. Ziel einer Stammzellenbehandlung ist es daher, die Schmerzen schnell zu lindern, die Entzündung zu hemmen und im besten Fall sogar die Regeneration zu unterstützen. Die Wirkung auf die Regeneration hat die höchsten Erfolgsaussichten, wenn sie mit intensiven, modernen Formen der Physiotherapie wie dem HAL-Exoskelett-Programm kombiniert wird. Dies kann die Lebensqualität, insbesondere bei Patienten mit starken Schmerzen, sowie die Bewegungsdauer und den Bewegungsumfang drastisch erhöhen.
Wie behandeln wir? Individuelle Behandlungskonzepte
Alle Therapiekonzepte der ANOVA sind individuell auf Sie als Patienten zugeschnitten. Wir berücksichtigen Ihre Vorgeschichte, Ihre Wünsche und Ihren spezifischen Krankheitsverlauf. Je nach Art und Schwere des Defekts sowie akuter oder chronischer Ursache, stellen wir Ihnen einen optimalen Behandlungsplan zusammen. Dieser kann eine einmalige Behandlung oder eine mehrfache Stammzellbehandlung sowie weitere Therapieformen beinhalten. Folgende Therapieformen wenden wir bei Knieverletzungen an:
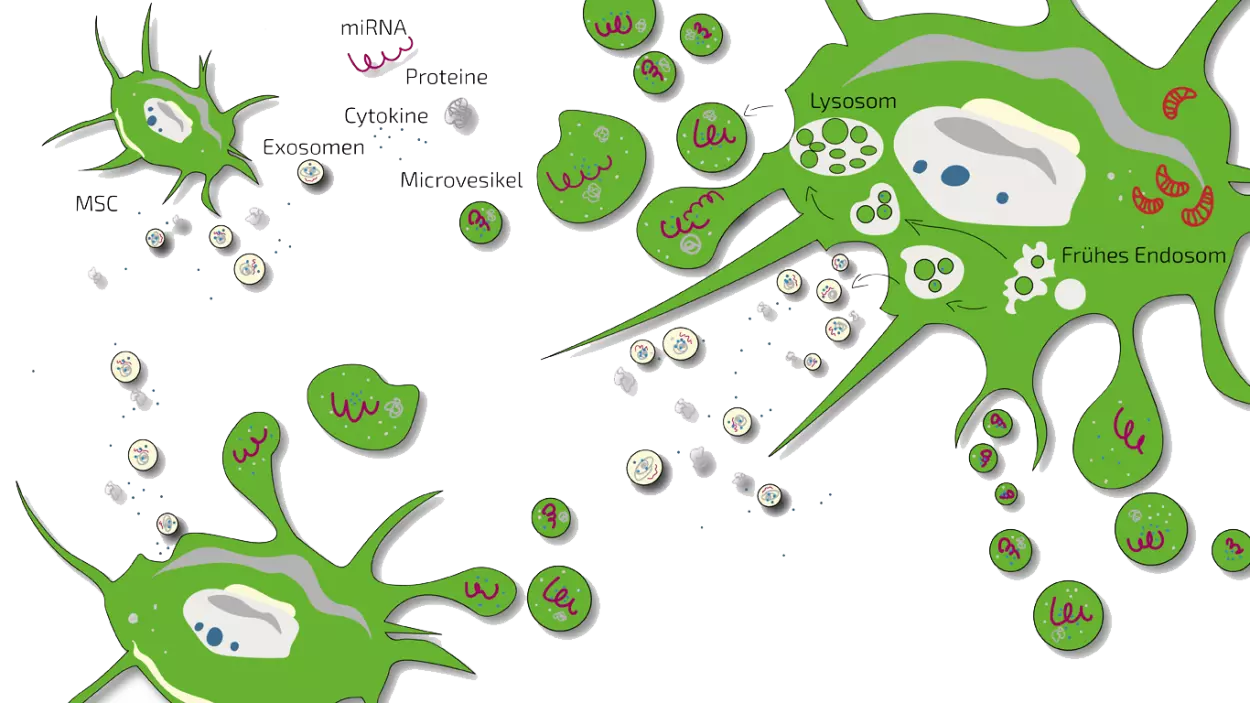
MSEC - Sekretom mesenchymaler Stammzellen – Exosomen
Je nach Art der SCI behandeln wir die Patienten entweder mit MSEC oder BMC oder einer Kombination aus beiden. MSEC (Sekretome, Exosomen, EVs) aus mesenchymalen Stammzellen (MSC, AD-MSC, aus Fettgewebe gewonnene Stammzellen), die wir bei einer Mini-Liposuktion (sehr kurze und begrenzte Fettabsaugung) unter leichter Sedierung aus dem Bauch des Patienten gewinnen, werden intravenös verabreicht und sollen eher systemisch wirken. ANOVA ist weltweit die erste Stammzellklinik, die von den zuständigen staatlichen Behörden eine gesetzliche Genehmigung erhalten hat und somit qualitativ hochwertige, sichere und gesetzlich kontrollierte autologe (eigene) exosomhaltige Sekrete anbietet.
Der Hauptvorteil von MSEC besteht darin, dass sie ohne Verlust von Exosomen eingefroren werden können, was im Gegensatz zu lebenden Stammzellen steht, die ihre therapeutische Wirksamkeit verlieren würden. Dies ermöglicht es uns, 10-20 Injektionsdosen aus einer Fettabsaugung herzustellen, die dann über einen längeren Behandlungszeitraum verabreicht werden können. Dies ist besonders bei Rückenmarksverletzungen von Vorteil. Die Definition und Funktion von Secretom/Exosom wird auf unserer Übersichtsseite erklärt. Bitte beachten Sie, dass diese Behandlung mit dem unten aufgeführten HAL-Training kombiniert werden sollte und eine wiederholte Anreise nach Offenbach (Deutschland) erfordert.
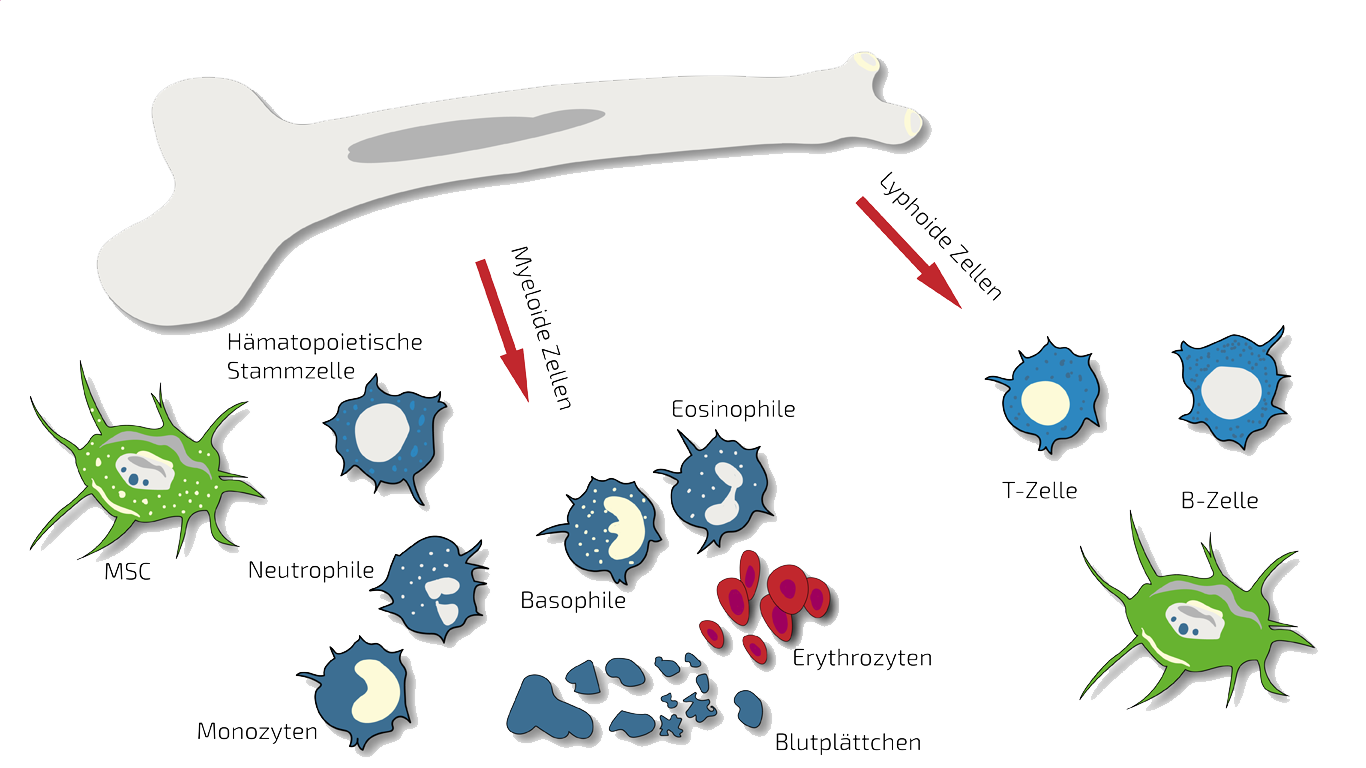
BMC - Knochenmark-Stammzellen
Autologes (eigenes) BMC ist die Art der Therapie, die wir bei lokal begrenzten Schäden bei SCI einsetzen, insbesondere wenn nur ein Wirbel betroffen ist.
In solchen Fällen behandeln wir speziell diese Region mit gezielten, lokalisierten BMC-Injektionen. BMC enthält autologe, adulte Stammzellen (hämatopoetische und mesenchymale Stammzellen in natürlicher Zusammensetzung), die wir in einem kurzen Verfahren unter leichter Sedierung aus dem Beckenkamm des Patienten isolieren und konzentrieren. Diese Stammzellen sollen die Entzündung hemmen und damit Ihre Schmerzen lindern und die Regeneration des geschädigten Knochens oder Knorpels anregen. Für eine fortlaufende Therapie kombinieren wir BMC mit den oben genannten MSEC. Mehr Informationen über diese Art der Stammzelltherapie finden Sie hier: BMC.
HAL® - Hybrid Assistive Limb - Robotik - Exoskelett
Seit 2019 kooperieren wir mit Cyberdyne Care Robotics.
Dieses japanische Unternehmen mit Niederlassungen in Deutschland (z.B. Bochum) bietet technisch hochmoderne Rehabilitationsverfahren und -programme mit Exoskeletten (HAL®, Hybrid Assistive Limb) und Funktionstraining für Patienten mit Rückenmarksverletzungen an, die nach der Physiotherapie eine Verbesserung zeigen (inkomplette SCI, responsive SCI).
Die gute Nachricht ist, dass Cyberdyne einen weiteren Meilenstein auf dem Weg zur Erstattung der Kosten für die HAL-Therapie durch die gesetzlichen Krankenkassen erreicht hat.
Querschnittgelähmte werden mit großem Erfolg in 3-monatigen Trainingsprogrammen behandelt, wenn in einer evaluativen ersten Sitzung Nervensignale messbar sind. Die Patienten erreichen in der Regel eine deutliche Verbesserung ihrer Bewegungsfähigkeit, bis hin zum Gehen mit Rollator oder Gehhilfe. Die Patienten bleiben 3 Monate in Bochum, Deutschland, und trainieren 5 Tage pro Woche. Eine Sitzung kostet etwa 500 Euro.
Viele Patienten kombinieren unsere MSEC- oder BMC-Behandlung mit diesen nervengesteuerten Exoskelett-Robotikprogrammen, um die Erfolgsaussichten weiter zu erhöhen.
Auch hierzu beraten wir Sie gerne! Oder lesen Sie mehr in den folgenden Abschnitten oder in unserem aktuellen Flyer.

Cyberdyne HAL-Robotik SCI-Training
ANOVA IRM - Deutschland © Cyberdyne
PRP - Plättchen-reiches Plasma (platelet-rich plasma)
PRP ist eine vergleichsweise einfache experimentelle Therapie, da hier nur Blutplättchen (sogenannte Throbozyten) aus Ihrem Blut, aber keine Stammzellen isoliert werden. Sie dienen der Unterstützung der Wundheilung und der Förderung des Zellwachstums. PRP wird jedoch bei alleiniger Gabe keine große Wirkung auf entzündliche Reaktionen zugesprochen.
Daher wenden wir PRP bei Knieverletzungen eher als Kombinationstherapie mit BMC an.
Mehr zu PRP (als Kombinationstherapie) finden Sie auf unserer PRP-Therapieseite.
Hyaluronsäure - HA
Eine weitere unterstützende Therapieform ist die Injektion von Hyaluronsäure ins Gelenk.
Dies vermindert ebenfalls Schmerzen und führt zu einer besseren "Schmierung" der Gelenke. Hyaluronsäure allein hat jedoch kaum regenerative Effekte.
Daher kombinieren wir die Behandlung meist mit einer BMC-Behandlung.
Hyaluronsäure - ANOVA IRM - Deutschland
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben Sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
Therapieablauf für die Stammzellenbehandlung von Rückenmarksverletzungen
Der genaue Ablauf ist auf den stammzellspezifischen Seiten von SeKretom/Exosomen und BMC detailliert beschrieben.
Alle Therapien gliedern sich in die Phasen Anamnese (wir analysieren Ihre bisherigen Therapien und Krankenakten), Erstberatung und Bewertung des möglichen Therapieergebnisses für Ihre spezielle Situation, Besprechung des patientenindividuellen Nutzens einer Stammzelltherapie (Indikationsstellung), Voruntersuchungen, Diagnostik, Beratung zu allen Therapieoptionen. Schließlich wird die Erstellung eines individuellen Behandlungsplans, inklusive Kostenvoranschlag, Gewebeentnahme, Herstellung und Qualitätskontrolle des Stammzellprodukts und Anwendung geplant.
Darüber hinaus applizieren wir die Stammzellen (BMC) häufig intraartikulär (d.h. direkt in das Gelenk). Das bedeutet, dass wir die Stammzellen genau an den Ort bringen, an dem Ihre Schmerzen entstehen.
Leider können wir aufgrund des Nutzen-Risiko-Verhältnisses keine Kinder oder schwangere Frauen behandeln. Darüber hinaus können auch andere Faktoren ein Ausschlusskriterium sein.
Wie lange dauert eine Stammzelltherapie?
Die ersten Analysen und Beratungen können durchgeführt werden, ohne dass Sie nach Offenbach (in der Nähe von Frankfurt am Main, Deutschland) reisen müssen. Dieser Zeitraum kann je nach Verfügbarkeit von Patientenplätzen 2 Wochen bis zu Monaten betragen. Wenn Sie weiter weg wohnen, werden wir die Erstgespräche per Telefon oder Videokonferenz führen. Für die eigentliche Behandlung müssen Sie nach Offenbach reisen. Die Entnahme des Gewebes, die Qualitätskontrolle und die Behandlung verlaufen dann je nach Therapieverfahren ungefähr nach diesen Zeitvorgaben:
Sekretom/Exosomen-Behandlung:
Für die Entnahme und Aufbereitung und Gewinnung des Fettes (Mini-Liposuktion) sind 2 Tage (konsekutiv) in Offenbach erforderlich. Danach erfolgt die Anreicherung der mesenchymalen Stammzellen (Sekretome/Exosomen) und die entsprechende Qualitätskontrolle.
Ca. 4 Wochen nach der Isolierung kann die Therapie nach dem mit Ihnen festgelegten Therapieplan beginnen. Sie kommen dann mehrmals zur Anwendung nach Offenbach am Main (Deutschland) zurück. Die Haltbarkeit der Sekretome (Exosomen) beträgt ca. 2 Jahre.
Wie viel kostet eine Stammzellenbehandlung bei Rückenmarksverletzungen?
Unsere Behandlungen sind immer auf Ihre spezifische Situation, Ihre Erkrankung, Ihr Stadium und andere Faktoren zugeschnitten. Die Therapien unterscheiden sich durch das verwendete Produkt (BMC, Sekretom,), die Häufigkeit der Behandlung sowie die weiteren Untersuchungen und Ihre Sedierungs- und Anästhesiewünsche. Eine Behandlung bei Rückenmarksverletzungen kostet in Kombination mit dem HAL-Training mehrere zehntausend Euro. Für alle Behandlungen erhalten Sie vorab einen Kostenvoranschlag, damit Sie genau abschätzen können, was eine Behandlung in Ihrem individuellen Fall kosten würde.
Übernimmt meine Krankenkasse die Therapiekosten?
Leider ist derzeit davon auszugehen, dass die Krankenkassen die Kosten für experimentelle Therapien (BMC, Sekretom, PRP) nicht übernehmen, d.h. Sie müssen die Kosten komplett selbst tragen.
Workflow Stammzellen und robotische Exoskelette:
REMCell-Therapie - Ein neuartiger Ansatz zur Neuro-Rehabilitation
Das ANOVA Institut für Regenerative Medizin, Deutschlands Pioniereinrichtung für Stammzelltherapien, und Cyberdyne, der japanische Pionier für robotergestütztes Neurofunktionstraining, haben sich zusammengeschlossen, um eine neuartige und wirksame Behandlung für Rückenmarksverletzungen zu entwickeln: REMCell, robotisches Exoskelett und mesenchymale Stammzellentherapie. REMCell integriert die Neuroregeneration (NR) mit Stammzellen und das neurofunktionelle Training (NF) mit dem HAL-Roboter-Exoskelett. Damit haben sie die derzeit vielversprechendste und wahrscheinlich wirksamste Methode zur funktionellen Wiederherstellung nach einer Rückenmarksverletzung geschaffen.
Ablauf der Therapie: Ein kompletter Kurs der REMCell-Therapie dauert 3 Monate
Phase 1 - Bewertung der Eignung für die REMCell-Therapie
Die Patienten werden zunächst daraufhin untersucht, ob noch Nervensignale in ihren Beinen vorhanden sind und ob sie als Spender für mesenchymale Stammzellen geeignet sind. Wenn diese Tests positiv ausfallen, kann mit der REMCell-Therapie begonnen werden.
Die erste Phase dauert für den Patienten ein oder zwei Tage, und es dauert etwa eine Woche, bis die Ergebnisse aus den Labors zurückkommen.
Phase 2 - Entnahme der Stammzellen und Sekretomherstellung
Die Stammzelltherapie erfordert die Entnahme von mesenchymalen Stammzellen (MSC) aus dem Unterhautfettgewebe, die mit einer Mini-Liposuktion, ähnlich der kosmetischen Fettabsaugung, durchgeführt wird. Es handelt sich um einen minimalinvasiven Eingriff, der etwa eine Stunde im OP und insgesamt einen halben Tag für den Patienten in Anspruch nimmt.
Die Stammzellen werden dann aus dem Fett isoliert und im Labor gezüchtet. Wenn eine ausreichende Anzahl von Stammzellen gezüchtet wurde, werden die Zellen bestimmten Bedingungen ausgesetzt, die die Sekretom-Produktion der Zellen optimieren. Es können 10 oder 20 Dosen von MSC-Sekretom hergestellt und für maximal zwei Jahre gelagert werden. Die Herstellung nimmt 4 Wochen in Anspruch.
Phase 3 - Neurofunktionelles Training und neuro-regenerative Stammzellenbehandlung
Unmittelbar nach der Stammzellenentnahme beginnt der Patient mit dem HAL-Training, 5 Tage pro Woche mit einer täglichen Einheit von 1 - 2 Stunden. Die Wochenenden sind frei.
Nach 4 Wochen Training ist die MSC-Sekretom-Produktion abgeschlossen und die erste Infusion von MSC-Sekretom wird durchgeführt. Alternativ zur intravenösen Infusion kann das MSC-Sekret auch intrathekal, d.h. in die das Rückenmark und das Gehirn umgebende Liquorflüssigkeit (CSF), injiziert werden. Je nachdem, ob 10 oder 20 Dosen des MSC-Sekretoms hergestellt wurden, erhält der Patient alle zwei Wochen oder wöchentlich Infusionen/Injektionen.
Wie können Sie an den Projekten von ANOVA und Cyberdyne teilnehmen?
Kombinierte neuro-regenerative und neuro-funktionelle Therapie?
Für die neuro-muskuläre Feedback-Therapie bei querschnittsgelähmten Patienten müssen schwache neurologische Restimpulse in der Muskulatur vorhanden und stark genug sein, um erfasst zu werden. Auch die anderen Patientengruppen, Schlaganfallpatienten und neuromuskuläre Patienten, müssen die entsprechenden Voraussetzungen erfüllen. Für die Stammzellgewinnung muss die Eignung des Spenders festgestellt werden.
Um herauszufinden, ob Sie von der kombinierten Stammzell- und HAL-Trainingstherapie von ANOVA und Cyberdyne profitieren können, sprechen Sie mit unseren Patientenbetreuern. Wir werten Ihre medizinischen Unterlagen aus und beurteilen Sie vor Ort.
Patientenbericht nach HAL-Therapie
Gianna Regenbrecht
Sich selbst wieder laufen zu sehen, das ist wirklich berührend!
Seit ich im November 2014 mit dem Training bei HAL begonnen habe, bin ich meinem Traum, meinen Alltag wieder auf eigenen Füßen bewältigen zu können, einen großen Schritt näher gekommen. Ich habe wieder Gefühl in meinen Beinen und meine Muskeln sind viel stärker geworden. Im Alltag bedeutet das, dass ich kurze Strecken mit einem Rollator oder Krücken gehen kann, dass ich aufstehen kann, um höhere Dinge zu erreichen, dass ich mit etwas Hilfe Treppen steigen kann und dass ich meinen Rollstuhl in den Kofferraum legen und zu Fuß ins Auto einsteigen kann. Das bedeutet für mich einen selbstbestimmteren Alltag und sehr viel mehr Selbstvertrauen.
Wie unterscheidet sich die ANOVA-Therapie?
Diagnostik - Wir suchen nach der Ursache Ihrer Schmerzen
Dr. mult. Michael K. Stehling, der Gründer von ANOVA IRM und dem Vitus Prostata Zentrum, ist Radiologe und promovierter Physiker. Aus diesem Grund verfügt das ANOVA Institut für Regenerative Medizin in Zusammenarbeit mit dem im selben Gebäude ansässigen Institut für Bildgebende Diagnostik über die Möglichkeit, spezielle Präzisionsdiagnostik wie Arthro-MRT und nicht-radioaktive Kontrastmittel-MRTs einzusetzen.
Im Vergleich zu vielen konventionellen MRTs sind diese Methoden oft in der Lage, die schmerzverursachenden Entzündungen, Degenerationen und Schäden in der Wirbelsäule und den Wirbeln zu lokalisieren. So können wir individuell bestimmen, wie die Patienten behandelt werden und wo die Stammzellen eingesetzt werden sollen.
Darüber hinaus ergänzen wir unsere patientenspezifische Diagnostik in Absprache mit Ihnen, wenn nötig oder sinnvoll, durch gezielte Blutuntersuchungen von Hormonen, Entzündungsparametern und anderen in Ihrem Fall wichtigen Faktoren oder empfehlen weitere Untersuchungen wie z.B. eine präventive MRT-Wirbelsäulenuntersuchung.
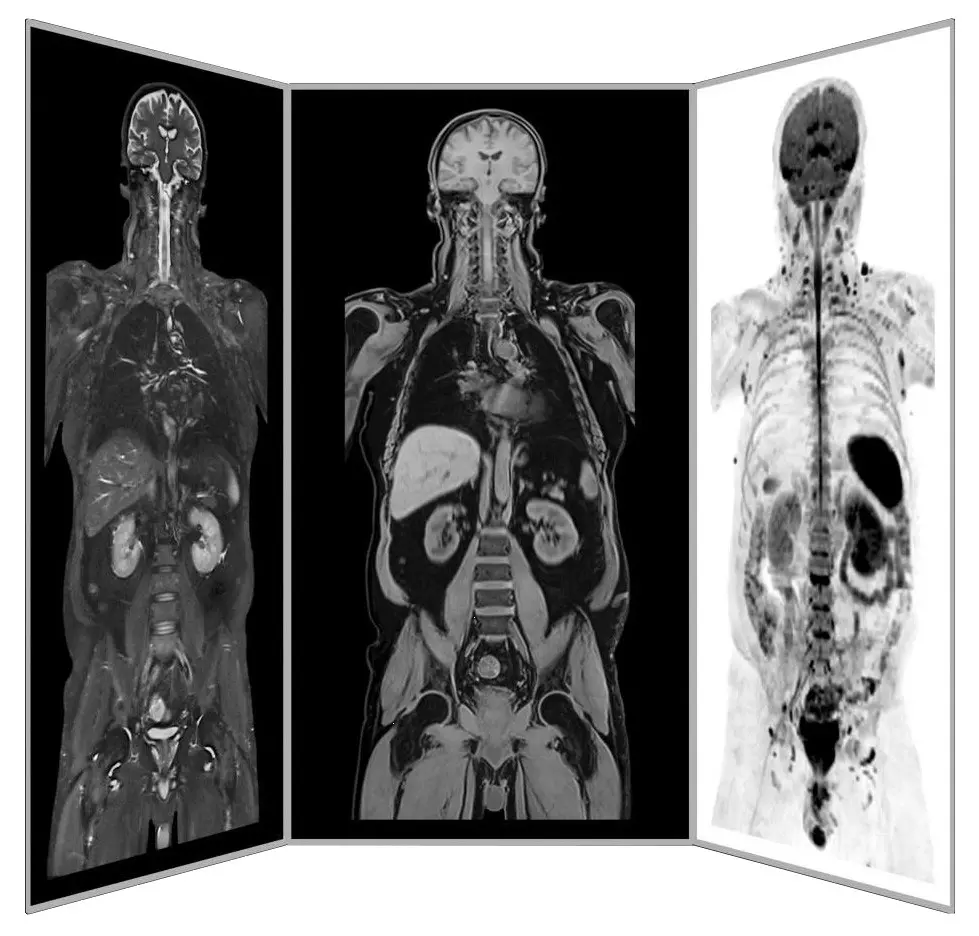
ANOVA IRM © Siemens Healthcare GmbH
Wie unterscheidet sich die ANOVA-Therapie?
Wir implantieren die Stammzellen genau dort, wo sie benötigt warden
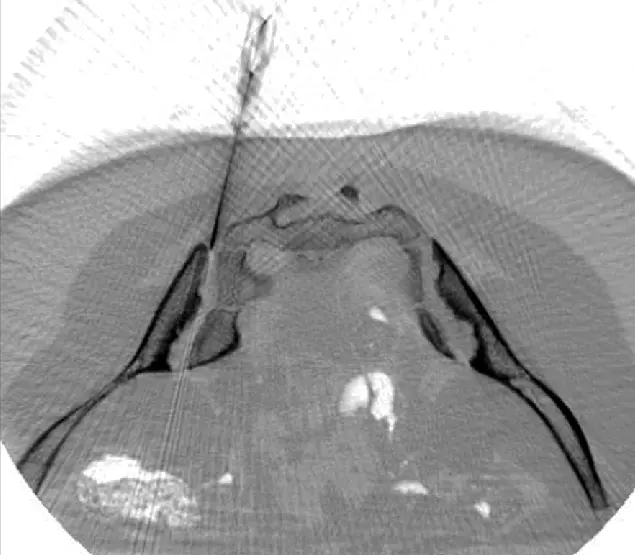
ANOVA IRM © Siemens Healthcare GmbH
Aufgrund unserer spezifischen Diagnostik mittels Arthro-MRT und nicht-radioaktivem Kontrastmittel-MRT können wir, im Gegensatz zu vielen anderen Kliniken, die Stammzellen bildgestützt, z.B. mittels CT, genau an die betroffene Stelle bringen. So können wir in und an Gelenke, Wirbel und Bänder spritzen, um gezielt und schnell dort eine Wirkung auszulösen, wo eine Entzündung Schmerzen verursacht. Alle Eingriffe werden unter Aufsicht und Betreuung unseres Anästhesisten durchgeführt und sind schmerzfrei.
Eine rein intravenöse Verabreichung, wie in vielen anderen Kliniken, erfolgt nur bei den Sekretomen (Exosomen), wenn diese zur Behandlung chronisch entzündlicher Erkrankungen des Knies eingesetzt werden sollen.
Selbstverständlich werden wir Sie im Vorfeld und in der Vor-Ort-Sprechstunde ausführlich über alle Schritte beraten und Alternativen und Erwartungen besprechen.
Sind Sie interessiert, aber unsicher? Vereinbaren Sie einen Beratungstermin!
Unsere Patient Care Manager informieren Sie gerne darüber, welche Informationen wir im Vorfeld benötigen (MRT, CT, Röntgen), wie Sie große Dateien übertragen können und vereinbaren einen Beratungstermin mit unseren Ärzten für Sie. Unsere Patient Care Manager informieren Sie gerne darüber, welche Informationen wir im Vorfeld benötigen, wie Sie große Dateien übermitteln können und vereinbaren einen Beratungstermin mit unseren Ärzten für Sie. Bitte nutzen Sie unser Kontaktformular, um eine schnelle Bearbeitung Ihres Falles und Ihrer Anfrage zu unterstützen.
Sie können uns auch gerne eine E-Mail zu Ihrem Fall schicken. Der Beratungstermin kann auch per Telefon oder Videochat stattfinden, wenn Sie außerhalb Deutschlands wohnen. Für eine intensivere Beratung oder zusätzliche diagnostische Abklärungen können Sie auch einen Vor-Ort-Termin buchen. Erforderliche MRT-Untersuchungen können wir noch am selben Tag durchführen. Alle von unserem Patientenbetreuungsteam erbrachten Dienstleistungen sind kostenlos, und wir informieren Sie im Voraus über alle Gebühren für Arzttermine.
Neurofunktionelles Training mit dem HAL-Roboter-Exoskelett
Nach einer Schädel-Hirn-Verletzung sind die Nervensignale vom Gehirn zu den Muskeln in den Beinen (efferente Signale) möglicherweise zu schwach, um die Muskeln zu bewegen. Bei vielen Patienten lassen sich diese Nervensignale jedoch noch mit empfindlichen Elektroden aufzeichnen. Mit dem HAL-Roboter-Exoskelett werden die schwachen Nervensignale verstärkt und genutzt, um Elektromotoren zu aktivieren, die wiederum die Beine des Patienten auf fast natürliche Weise bewegen.
Dabei werden in sogenannten Propriozeptoren in den Muskeln und Gelenken Nervensignale erzeugt, die an das Gehirn zurückgemeldet werden (afferente Signale). Diese afferenten Signale, die von den Beinen ausgehen und zum Gehirn gehen, und die efferenten Signale, die über das Rückenmark zu den peripheren Nerven laufen, bilden eine Rückkopplungsschleife. Bei Patienten mit SCI ist diese Rückkopplungsschleife unterbrochen und degeneriert mit der Zeit.
Funktionelle MRT-Studien, mit denen die Hirnaktivität sichtbar gemacht werden kann, haben gezeigt, dass die Bereiche im motorischen Kortex des Gehirns (Gyrus praecentralis), die spezifische Bewegungen der Beine steuern und normalerweise sehr auf kleine Bereiche des motorischen Kortex konzentriert sind, bei Patienten mit SCI über größere Bereiche "verschmieren". Dies könnte die freiwillige Initiierung von Bewegungen durch tiefere Funktionszentren des Gehirns behindern.
Während des HAL-Trainings wird die funktionelle Aktivität wieder auf die ursprünglichen kleineren Bereiche fokussiert. Es scheint also, dass die Wiederherstellung der Rückkopplungsschleife, insbesondere des sensorischen Inputs von den Propriozeptoren im Bein zum Gehirn, ein wesentlicher Bestandteil der willentlichen Bewegung ist.
Hoffnung für SCI-Patienten - Wissenschaftliche Ergebnisse mit Stammzellen
Ein Wirbelsäulentrauma kann auf- und absteigende axonale Bahnen unterbrechen, die zu Entzündungen, Demyelinisierung und Verlust von Nervenzellen (Neuronen) führen. Je nach dem Ort der Verletzung führen die durch die Zellschädigung verursachten Funktionsstörungen in der Regel zu Bewegungsunfähigkeit, Verlust von Sinneseindrücken und/oder fehlender autonomer Kontrolle des Nervensystems. Vollständig regenerative Therapien für Wirbelsäulentraumata gibt es noch nicht. Es wurden jedoch sehr vielversprechende Ergebnisse mit der Stammzelltransplantation bei Patienten mit Wirbelsäulentrauma erzielt. Die Verwendung von mesenchymalen Stammzellen (MSC) bei Rückenmarksverletzungen wurde bereits ausführlich untersucht. Experimente mit MSZ haben gezeigt, dass ihre Fähigkeit, Reparaturprozesse bei Rückenmarksverletzungen zu stimulieren, auf die parakrine Sekretion bioaktiver Substanzen durch die MSZ zurückzuführen ist. Bereits eine Woche nach der Behandlung mit MSZ zeigte sich nach 21 Tagen Beobachtung eine signifikante Verbesserung der funktionellen Erholung, obwohl die MSZ noch nicht in das regenerierte Wirtsgewebe eingebaut waren.
Die Fortschritte auf diesem Gebiet wurden kürzlich in der wissenschaftlichen Arbeit von Lamichhane und Kollegen untersucht.
Es gibt keine (experimentelle oder etablierte) Behandlung, für die Ihr behandelnder Arzt einen Therapieerfolg versprechen oder gar garantieren kann. Bei der Stammzelltherapie, die eine experimentelle Behandlung ist, sind die Ärzte verpflichtet, Nutzen und Risiken in jedem Einzelfall zu analysieren und sicherzustellen, dass der Nutzen der Therapie die Risiken überwiegt. Wenn dies der Fall ist, kann Ihr Arzt eine Behandlung mit Stammzellen vorschlagen.
Neuro-Regeneration mit mesenchymalem Stammzellsekretom
Die präklinische Forschung hat die verschiedenen Wirkungen mesenchymaler Stammzellen (MSC) und ihres Sekretoms auf Rückenmarksverletzungen aufgeklärt. Es gibt mehrere wichtige Verletzungsmechanismen, die zu funktionellen Beeinträchtigungen bei SCI führen: Absterben von Neuronen und Glia (Stützzellen), Unterbrechung von Axonen (Nervenbahnen), Vernarbung von Glia und Verlust von Gefäßen/Blutversorgung.
Während sich die ursprüngliche Annahme, dass Stammzellen verlorene Nervenzellen ersetzen und so die Funktion wiederherstellen, nicht bewahrheitet hat, beeinflussen MSZ und ihr Sekretom viele der anderen Elemente der Schädigung positiv. Es hat sich gezeigt, dass sie die Architektur der glialen Narben reorganisieren und das Wachstum der Axone fördern, indem sie die Wiederverbindung der Nervenbahnen über die glialen Narben hinweg unterstützen und so die Leitfähigkeit der Nervensignale im Rückenmark verbessern. Gleichzeitig wurde gezeigt, dass MSCs die Vaskularisierung und Blutversorgung in geschädigten Bereichen des Rückenmarks verbessern, indem sie das Wachstum neuer Blutgefäße anregen. Dies ist eine entscheidende Komponente für die Wiederherstellung einer normaleren Mikroarchitektur des Rückenmarks.
Geben Sie Ihrem Körper eine Chance, sich zu erholen - Erhalten Sie Zugang zur neuesten Generation der Regenerationsmedizin
Mit der neuesten Generation von Stammzellbehandlungen, dem Stem Cell Secretome, bietet ANOVA, unsere deutsche Stammzellklinik, ein einzigartiges und wirksames Produkt an, das gut mit Ihrer körperlichen Rehabilitation harmoniert.
Informieren Sie sich über Ihre Möglichkeiten, sich mit unseren stammzellbasierten Produkten behandeln zu lassen.
Wenden Sie sich an unser medizinisches Team bei ANOVA, um herauszufinden, welche Stammzelltherapie bei Rückenmarksverletzungen für Sie die ideale Behandlungsoption ist.
Immunfluoreszenzfärbung von Zellen
Lesen Sie mehr
Repair of injured spinal cord using biomaterial scaffolds and stem cells
Euro Stemcell foundation: How could stem cells help with spinal cord injuries
Paralysed man walks again after cell transplant
Christopher and Dana Reeve Foundation
Stem cell clinical trial aims to combat nerve damage in human tissue
Stem Cell Secretome for Spinal Cord Repair: Is It More than Just a Random Baseline Set of Factors?
Referenzen und Literatur - Stammzellbasierte Therapien und Rückenmarksverletzungen
- A. Hejcl, J. Sedy, M. Kapcalova, D.A. Toro, T. Amemori, P. Lesny, K. Likavcanova-Masinova, E. Krumbholcova, M. Pradny, J. Michalek, M. Burian, M. Hajek, P. Jendelova, E. Sykova, HPMA-RGD hydrogels seeded with mesenchymal stem cells improve functional outcome in chronic spinal cord injury, Stem Cells Dev. 19 (2010) 1535e1546.
- Anthony, Diana F., and Paul G. Shiels. "Exploiting paracrine mechanisms of tissue regeneration to repair damaged organs." Transplantation research 2.1 (2013): 10.
- Wright KT, Masri WE, Osman A, Chowdhury J, Johnson WEB: Concise review: bone marrow for the tre atment of spinal cord injury: mechanisms and clinical implications. Stem Cells 2011, 29: 169 – 178
- Quertainmont R, Cantinieaux D, Bot man O, Eid S, Schoenen J, Franzen R: Mesenchymalstemcellgraftimproves recovery after spinal cord injury in adult rats through neurotrophic and pro-angiogenic actions. PLoS One 2012, 7: e39500.
- Lamichhane, Tek N., et al. "Emerging roles for extracellular vesicles in tissue engineering and regenerative medicine." Tissue Engineering Part B: Reviews 21.1 (2014): 45-54.
- Thuret, Sandrine, Lawrence DF Moon, and Fred H. Gage. "Therapeutic interventions after spinal cord injury." Nature Reviews Neuroscience 7.8 (2006): 628-643.
- Thuret, Sandrine, Lawrence DF Moon, and Fred H. Gage. "Therapeutic interventions after spinal cord injury." Nature Reviews Neuroscience 7.8 (2006): 628-643.
- Lindvall O, Kokaia Z: Stem cells for the treatment of neurological disorders. Nature 2006, 441(7097):1094-1096.
- Yoon SH, Shim YS, Park YH, Chung JK, Nam JH, Kim MO, Park HC, Park SR, Min BH, Kim EY, et al: Complete spinal cord injury treatment using autologous bone marrow cell transplantation and bone marrow stimulation with granulocyte macrophage-colony stimulating factor: Phase I/II clinical trial. Stem Cells 2007, 25(8):2066-2073.
- Karamouzian S, Nematollahi-Mahani SN, Nakhaee N et al (2012) Clinical safety and primary efficacy of bone marrow mesenchymal cell transplantation in subacute spinal cord injured patients. Clin Neurol Neurosurg 114(7):935–939
- Saito F, Nakatani T, Iwase M et al (2008) Spinal cord injury treatment with intrathecal autologous bone marrow stromal cell transplantation: the first clinical trial case report. J Trauma 64(1):53–59
- Saito F, Nakatani T, Iwase M et al (2012) Administration of cul¬tured autologous bone marrow stromal cells into cerebrospinal fluid in spinal injury patients: a pilot study. Restor Neurol Neu¬rosci 30(2):127–136
Weitere Referenzen über MSEC und Stammzelltherapien bei Rückenmarksverletzungen
- Ramer L.M., Ramer M.S., Bradbury E.J. Restoring function after spinal cord injury: Towards clinical translation of experimental strategies. Lancet Neurol. 2014;13:1241–1256. https://doi.org/10.1016/S1474-4422(14)70144-9.
- Silva N.A., Sousa N., Reis R.L., Salgado A.J. From basics to clinical: A comprehensive review on spinal cord injury. Prog. Neurobiol. 2014;114:25–57. https://doi.org/10.1016/j.pneurobio.2013.11.002.
- Bradbury E.J., Burnside E.R. Moving beyond the glial scar for spinal cord repair. Nat. Commun. 2019;10:3879. https://doi.org/10.1038/s41467-019-11707-7.
- Schuld C., Franz S., Bruggemann K., Heutehaus L., Weidner N., Kirshblum S.C., Rupp R., EMSCI study group International standards for neurological classification of spinal cord injury: Impact of the revised worksheet (revision 02/13) on classification performance. J. Spinal Cord Med. 2016;39:504–512. https://doi.org/10.1080/10790268.2016.1180831.
- Anderson D.K., Means E.D., Waters T.R., Green E.S. Microvascular perfusion and metabolism in injured spinal cord after methylprednisolone treatment. J. Neurosurg. 1982;56:106–113. https://doi.org/10.3171/jns.1982.56.1.0106.
- Oyinbo C.A. Secondary injury mechanisms in traumatic spinal cord injury: A nugget of this multiply cascade. Acta Neurobiol. Exp. 2011;71:281–299.
- Kakulas B.A. Neuropathology: The foundation for new treatments in spinal cord injury. Spinal Cord. 2004;42:549–563. https://doi.org/10.1038/sj.sc.3101670.
- Rowland J.W., Hawryluk G.W., Kwon B., Fehlings M.G. Current status of acute spinal cord injury pathophysiology and emerging therapies: Promise on the horizon. Neurosurg. Focus. 2008;25:E2. https://doi.org/10.3171/FOC.2008.25.11.E2
- Donnelly D.J., Popovich P.G. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury. Exp. Neurol. 2008;209:378–388. https://doi.org/10.1016/j.expneurol.2007.06.009
- Pires A.O., Mendes-Pinheiro B., Teixeira F.G., Anjo S.I., Ribeiro-Samy S., Gomes E.D., Serra S.C., Silva N.A., Manadas B., Sousa N., et al. Unveiling the Differences of Secretome of Human Bone Marrow Mesenchymal Stem Cells, Adipose Tissue-Derived Stem Cells, and Human Umbilical Cord Perivascular Cells: A Proteomic Analysis. Stem Cells Dev. 2016;25:1073–1083. https://doi.org/10.1089/scd.2016.0048.
- Nagoshi N., Nakashima H., Fehlings M.G. Riluzole as a neuroprotective drug for spinal cord injury: From bench to bedside. Molecules. 2015;20:7775–7789. https://doi.org/10.3390/molecules20057775.
- Salewski R.P., Mitchell R.A., Li L., Shen C., Milekovskaia M., Nagy A., Fehlings M.G. Transplantation of Induced Pluripotent Stem Cell-Derived Neural Stem Cells Mediate Functional Recovery Following Thoracic Spinal Cord Injury Through Remyelination of Axons. Stem Cells Transl. Med. 2015;4:743–754. https://doi.org/10.5966/sctm.2014-0236
- Zakrzewski W., Dobrzynski M., Szymonowicz M., Rybak Z. Stem cells: Past, present, and future. Stem Cell Res. Ther. 2019;10:68. https://doi.org/10.1186/s13287-019-1165-5.
- Chen C.J., Ou Y.C., Liao S.L., Chen W.Y., Chen S.Y., Wu C.W., Wang C.C., Wang W.Y., Huang Y.S., Hsu S.H. Transplantation of bone marrow stromal cells for peripheral nerve repair. Exp. Neurol. 2007;204:443–453. https://doi.org/10.1016/j.expneurol.2006.12.004
Literatur über progressive neuromuskuläre Erkrankungen und HAL-Training
- Grasmücke D., Zieriacks A., Jansen O., Fisahn Ch., Sczesny-Kaiser M., Wessling M., Meindl R.C., Schildhauer T.A., Aach M. Against the odds: what to expect in rehabilitation of chronic spinal cord injury with a neurologically controlled Hybrid Assistive Limb exoskeleton. A subgroup analysis of 55 patients according to age and lesion level. Journal of Neurosurgery Vol. 42: Issue 5 https://doi.org/10.3171/2017.2.FOCUS171
- Brinkemper A., Grasmücke D., Yilmaz E., Reinecke F., Schildhauer T. A., Aach M. Influence of Locomotion Therapy With the Wearable Cyborg HAL on Bladder and Bowel Function in Acute and Chronic SCI Patients. Global Spine Journal April 16, 2021 https://doi.org/10.1177/21925682211003851
- Jansen O., Schildhauer T. A., Meindl R. C., Tegenthoff M., Schwenkreis T., Sczesny-Kaiser M., Grasmücke D., Fisahn Ch. Aach M. Functional Outcome of Neurologic-Controlled HAL-Exoskeletal Neurorehabilitation in Chronic Spinal Cord Injury: A Pilot With One Year Treatment and Variable Treatment Frequency.Global Spine Journal July 7, 2017 https://doi.org/10.1177/2192568217713754
- Jansen O., Grasmücke D., Meindl R. C., Tegenthoff M., Schwenkreis P., Sczesny-Kaiser M., Wessling M. Schildhauer T.A., Fisahn Ch., Aach M. Hybrid Assistive Limb Exoskeleton HAL in the Rehabilitation of Chronic Spinal Cord Injury: Proof of Concept; the Results in 21 Patients. World Neurosurgery, February2, 2018 https://doi.org/10.1016/j.wneu.2017.10.080
- Sczesny-Kaiser M., Höffken O., Aach M., Cruciger O., Grasmücke D., Meindl R., Schildhauer T.A., Schwenkreis P., Tegenthoff M. HAL® exoskeleton training improves walking parameters and normalizes cortical excitability in primary somatosensory cortex in spinal cord injury patients. Journal of NeuroEngineering and Rehabilitation, August 20, 2015 https://doi.org/10.1186/s12984-015-0058-9
- Aach M., Cruciger O., Sczesny-Kaiser M., Höffken O., Meindl R. C., Tegenthoff M., Schwenkreis P., Sankai Y., Schildhauer T. A. Voluntary driven exoskeleton as a new tool for rehabilitation in chronic spinal cord injury: a pilot study. The Spine Journal April 07, 2014 https://doi.org/10.1016/j.spinee.2014.03.042
- Puentes S., Kadone H., Kubota S., Abe T., Shimizu Y., Marushima A., Sankai Y., Yamazaki M., Suzuki K. Reshaping of Gait Coordination by Robotic Intervention in Myelopathy Patients After Surgery. Frontiers in Neuroscience March 02, 2018 https://doi.org/10.3389/fnins.2018.00099
- Cruciger O., Schildhauer T. A., Meindl R. C., Twegenthoff M., Schwenkreis P., Citak M., Aach M. Impact of locomotion training with a neurologic controlled hybrid assistive limb (HAL) exoskeleton on neuropathic pain and health related quality of life (HRQoL) in chronic SCI: a case study. Disability and Rehabilitation: Assistive Technology November 10, 2014 https://doi.org/10.3109/17483107.2014.981875
Weiterführende Literatur zu MSC, BMC, Stamzellen Secretom und EVs
- Georg Hansmann, Philippe Chouvarine, Franziska Diekmann, Martin Giera, Markus Ralser, Michael Mülleder, Constantin von Kaisenberg, Harald Bertram, Ekaterina Legchenko & Ralf Hass "Human umbilical cord mesenchymal stem cell-derived treatment of severe pulmonary arterial hypertension". Nature Cardiovascular Research volume 1, pages568–576 (2022).
- Murphy JM, Fink DJ, Hunziker EB, et al. Stem cell therapy in a caprine model of osteoarthritis . Arthritis Rheum. 2003;48:3464–74.
- Lee KB, Hui JH, Song IC, Ardany L, et al. Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model. Stem Cell. 2007;25:2964–71.
- Saw KY, Hussin P, Loke SC, et al. Articular cartilage regeneration with autologous marrow aspirate and hyaluronic acid: an experimental study in a goat model. Arthroscopy . 2009;25(12):1391–400.
- Black L, Gaynor J, Adams C, et al. Effect of intra-articular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Vet Ther. 2008;9:192-200.
- Centeno C, Busse D, Kisiday J, et al. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells. Pain Physician. 2008;11(3):343–53.
- Centeno C, Kisiday J, Freeman M, et al. Partial regeneration of the human hip via autologous bone marrow nucleated cell transfer: a case study. Pain Physician. 2006;9:253–6.
- Centeno C, Schultz J, Cheever M. Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique. Curr Stem Cell. 2011;5(1):81–93.
- Pak J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose derived stem cells: a case series. J Med Case Rep. 2001;5:296.
- Kuroda R, Ishida K, et al. Treatment of a full-thickness articular cartilage defect in the femoral condyle of an athlete with autologous bone-marrow stromal cells. Osteoarthritis Cartilage. 2007;15:226–31.
- Emadedin M, Aghdami N, Taghiyar L, et al. Intra-articular injection of autologous mesenchymal stem cells in six patients with knee osteoarthritis. Arch Iran Med. 2012;15(7):422–8.
- Saw KY et al. Articular cartilage regeneration with autologous peripheral blood stem cells versus hyaluronic acid: a randomized controlled trial. Arthroscopy. 2013;29(4):684–94.
- Vangsness CT, Farr J, Boyd J, et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy. J Bone Joint Surg. 2014;96(2):90–8.
- Freitag, Julien, et al. Mesenchymal stem cell therapy in the treatment of osteoarthritis: reparative pathways, safety and efficacy–a review. BMC musculoskeletal disorders 17.1 (2016): 230.
- Maumus, Marie, Christian Jorgensen, and Danièle Noël. " Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. " Biochimie 95.12 (2013): 2229-2234.
- Dostert, Gabriel, et al. " How do mesenchymal stem cells influence or are influenced by microenvironment through extracellular vesicles communication?. " Frontiers in Cell and Developmental Biology 5 (2017).
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- Toh, Wei Seong, et al. " MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. " Seminars in Cell & Developmental Biology. Academic Press, 2016.
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- S. Koelling, J. Kruegel, M. Irmer, J.R. Path, B. Sadowski, X. Miro, et al., Migratory chondrogenic progenitor cells from repair tissue during the later stages of human osteoarthritis , Cell Stem Cell 4 (2009) 324–335.
- B.A. Jones, M. Pei, Synovium-Derived stem cells: a tissue-Specific stem cell for cartilage engineering and regeneration , Tissue Eng. B: Rev. 18 (2012) 301–311.
- W. Ando, J.J. Kutcher, R. Krawetz, A. Sen, N. Nakamura, C.B. Frank, et al., Clonal analysis of synovial fluid stem cells to characterize and identify stable mesenchymal stromal cell/mesenchymal progenitor cell phenotypes in a porcine model: a cell source with enhanced commitment to the chondrogenic lineage, Cytotherapy 16 (2014) 776–788.
- K.B.L. Lee, J.H.P. Hui, I.C. Song, L. Ardany, E.H. Lee, Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model, Stem Cells 25 (2007) 2964–2971.
- W.-L. Fu, C.-Y. Zhou, J.-K. Yu, A new source of mesenchymal stem cells for articular cartilage repair: mSCs derived from mobilized peripheral blood share similar biological characteristics in vitro and chondrogenesis in vivo as MSCs from bone marrow in a rabbit model , Am. J. Sports Med. 42 (2014) 592–601.
- X. Xie, Y. Wang, C. Zhao, S. Guo, S. Liu, W. Jia, et al., Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration , Biomaterials 33 (2012) 7008–7018.
- E.-R. Chiang, H.-L. Ma, J.-P. Wang, C.-L. Liu, T.-H. Chen, S.-C. Hung, Allogeneic mesenchymal stem cells in combination with hyaluronic acid for the treatment of osteoarthritis in rabbits , PLoS One 11 (2016) e0149835.
- H. Nejadnik, J.H. Hui, E.P. Feng Choong, B.-C. Tai, E.H. Lee, Autologous bone marrow–derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study , Am. J. Sports Med. 38 (2010) 1110–1116.
- I. Sekiya, T. Muneta, M. Horie, H. Koga, Arthroscopic transplantation of synovial stem cells improves clinical outcomes in knees with cartilage defects , Clin. Orthop. Rel. Res. 473 (2015) 2316–2326.
- Y.S. Kim, Y.J. Choi, Y.G. Koh, Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors influencing clinical outcomes , Am. J. Sports Med. 43 (2015) 2293–2301.
- W.-L. Fu, Y.-F. Ao, X.-Y. Ke, Z.-Z. Zheng, X. Gong, D. Jiang, et al., Repair of large full-thickness cartilage defect by activating endogenous peripheral blood stem cells and autologous periosteum flap transplantation combined with patellofemoral realignment , Knee 21 (2014) 609–612.
- Y.-G. Koh, O.-R. Kwon, Y.-S. Kim, Y.-J. Choi, D.-H. Tak, Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial , Arthrosc. J. Arthrosc. Relat. Surg. 32 (2016) 97–109.
- T.S. de Windt, L.A. Vonk, I.C.M. Slaper-Cortenbach, M.P.H. van den Broek, R. Nizak, M.H.P. van Rijen, et al., Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-Stage cartilage repair in humans upon mixture with recycled autologous chondrons , Stem Cells (2016) (n/a-n/a).
- L. da Silva Meirelles, A.M. Fontes, D.T. Covas, A.I. Caplan, Mechanisms involved in the therapeutic properties of mesenchymal stem cells , Cytokine Growth Factor Rev. 20 (2009) 419–427.
- W.S. Toh, C.B. Foldager, M. Pei, J.H.P. Hui, Advances in mesenchymal stem cell-based strategies for cartilage repair and regeneration , Stem Cell Rev. Rep. 10 (2014) 686–696.
- R.C. Lai, F. Arslan, M.M. Lee, N.S.K. Sze, A. Choo, T.S. Chen, et al., Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury , Stem Cell Res. 4 (2010) 214–222.
- S. Zhang, W.C. Chu, R.C. Lai, S.K. Lim, J.H.P. Hui, W.S. Toh, Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration, Osteoarthr . Cartil. 24 (2016) 2135–2140.
- S. Zhang, W. Chu, R. Lai, J. Hui, E. Lee, S. Lim, et al., 21 – human mesenchymal stem cell-derived exosomes promote orderly cartilage regeneration in an immunocompetent rat osteochondral defect model , Cytotherapy 18 (2016) S13.
- C.T. Lim, X. Ren, M.H. Afizah, S. Tarigan-Panjaitan, Z. Yang, Y. Wu, et al., Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol) fumarate] hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model
- A. Gobbi, G. Karnatzikos, S.R. Sankineani, One-step surgery with multipotent stem cells for the treatment of large full-thickness chondral defects of the knee , Am. J. Sports Med. 42 (2014) 648–657.
- A. Gobbi, C. Scotti, G. Karnatzikos, A. Mudhigere, M. Castro, G.M. Peretti, One-step surgery with multipotent stem cells and Hyaluronan-based scaffold for the treatment of full-thickness chondral defects of the knee in patients older than 45 years , Knee Surg. Sports Traumatol. Arthrosc. (2016) 1–8.
- A. Gobbi, G. Karnatzikos, C. Scotti, V. Mahajan, L. Mazzucco, B. Grigolo, One-step cartilage repair with bone marrow aspirate concentrated cells and collagen matrix in full-thickness knee cartilage lesions: results at 2-Year follow-up , Cartilage 2 (2011) 286–299.
- K.L. Wong, K.B.L. Lee, B.C. Tai, P. Law, E.H. Lee, J.H.P. Hui, Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years’ follow-up , Arthrosc. J. Arthrosc. Relat. Surg. 29 (2013) 2020–2028.
- J.M. Hare, J.E. Fishman, G. Gerstenblith, et al., Comparison of allogeneic vs autologous bone marrow–derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy: the poseidon randomized trial, JAMA 308 (2012) 2369–2379.
- L. Wu, J.C.H. Leijten, N. Georgi, J.N. Post, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells increase chondrocyte proliferation and matrix formation , Tissue Eng. A 17 (2011) 1425–1436.
- L. Wu, H.-J. Prins, M.N. Helder, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells in chondrocyte Co-Cultures are independent of culture conditions and cell sources , Tissue Eng. A 18 (2012) 1542–1551.
- S.K. Sze, D.P.V. de Kleijn, R.C. Lai, E. Khia Way Tan, H. Zhao, K.S. Yeo, et al., Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells , Mol. Cell. Proteomics 6 (2007) 1680–1689.
- M.B. Murphy, K. Moncivais, A.I. Caplan, Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine , Exp. Mol. Med. 45 (2013) e54.
- M.J. Lee, J. Kim, M.Y. Kim, Y.-S. Bae, S.H. Ryu, T.G. Lee, et al., Proteomic analysis of tumor necrosis factor--induced secretome of human adipose tissue-derived mesenchymal stem cells , J. Proteome Res. 9 (2010) 1754–1762.
- S. Bruno, C. Grange, M.C. Deregibus, R.A. Calogero, S. Saviozzi, F. Collino, et al., Mesenchymal stem cell-derived microvesicles protect against acute tubular injury, J. Am. Soc. Nephrol. 20 (2009) 1053–1067.
- M. Yá˜nez-Mó, P.R.-M. Siljander, Z. Andreu, A.B. Zavec, F.E. Borràs, E.I. Buzas, et al. Biological properties of extracellular vesicles and their physiological functions (2015).
- C. Lawson, J.M. Vicencio, D.M. Yellon, S.M. Davidson, Microvesicles and exosomes: new players in metabolic and cardiovascular disease , J. Endocrinol. 228 (2016) R57–R71.
- A.G. Thompson, E. Gray, S.M. Heman-Ackah, I. Mager, K. Talbot, S.E. Andaloussi, et al., Extracellular vesicles in neurodegenerative diseas—pathogenesis to biomarkers, Nat. Rev. Neurol. 12 (2016) 346–357.
- I.E.M. Bank, L. Timmers, C.M. Gijsberts, Y.-N. Zhang, A. Mosterd, J.-W. Wang, et al., The diagnostic and prognostic potential of plasma extracellular vesicles for cardiovascular disease , Expert Rev. Mol. Diagn. 15 (2015) 1577–1588.
- T. Kato, S. Miyaki, H. Ishitobi, Y. Nakamura, T. Nakasa, M.K. Lotz, et al., Exosomes from IL-1 stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes , Arthritis. Res. Ther. 16 (2014) 1–11.
- R.W.Y. Yeo, S.K. Lim, Exosomes and their therapeutic applications, in: C. Gunther, A. Hauser, R. Huss (Eds.), Advances in Pharmaceutical Cell TherapyPrinciples of Cell-Based Biopharmaceuticals, World Scientific, Singapore, 2015, pp. 477–491.
- X. Qi, J. Zhang, H. Yuan, Z. Xu, Q. Li, X. Niu, et al., Exosomes secreted by human-Induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats , Int. J. Biol. Sci. 12 (2016) 836–849.
- R.C. Lai, F. Arslan, S.S. Tan, B. Tan, A. Choo, M.M. Lee, et al., Derivation and characterization of human fetal MSCs: an alternative cell source for large-scale production of cardioprotective microparticles , J. Mol. Cell. Cardiol. 48 (2010) 1215–1224.
- Y. Zhou, H. Xu, W. Xu, B. Wang, H. Wu, Y. Tao, et al., Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro , Stem Cell Res. Ther. 4 (2013) 1–13.
- Y. Qin, L. Wang, Z. Gao, G. Chen, C. Zhang, Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo , Sci. Rep. 6 (2016) 21961.
- M. Nakano, K. Nagaishi, N. Konari, Y. Saito, T. Chikenji, Y. Mizue, et al., Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes , Sci. Rep. 6 (2016) 24805.
- K. Nagaishi, Y. Mizue, T. Chikenji, M. Otani, M. Nakano, N. Konari, et al., Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes , Sci. Rep. 6 (2016) 34842.
- S.R. Baglio, K. Rooijers, D. Koppers-Lalic, F.J. Verweij, M. Pérez Lanzón, N. Zini, et al., Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species , Stem Cell Res. Ther. 6 (2015) 1–20.
- T. Chen, R. Yeo, F. Arslan, Y. Yin, S. Tan, Efficiency of exosome production correlates inversely with the developmental maturity of MSC donor, J. Stem Cell Res. Ther. 3 (2013) 2.
- R.C. Lai, S.S. Tan, B.J. Teh, S.K. Sze, F. Arslan, D.P. de Kleijn, et al., Proteolytic potential of the MSC exosome proteome: implications for an exosome-mediated delivery of therapeutic proteasome , Int. J. Proteomics 2012 (2012) 971907.
- T.S. Chen, R.C. Lai, M.M. Lee, A.B.H. Choo, C.N. Lee, S.K. Lim, Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs , Nucleic Acids Res. 38 (2010) 215–224.
- R.W. Yeo, R.C. Lai, K.H. Tan, S.K. Lim, Exosome: a novel and safer therapeutic refinement of mesenchymal stem cell, J. Circ. Biomark. 1 (2013) 7.
- R.C. Lai, R.W. Yeo, S.K. Lim, Mesenchymal stem cell exosomes, Semin. Cell Dev. Biol. 40 (2015) 82–88.
- B. Zhang, R.W. Yeo, K.H. Tan, S.K. Lim, Focus on extracellular vesicles: therapeutic potential of stem cell-derived extracellular vesicles , Int. J. Mol. Sci. 17 (2016) 174.
- Hu G-w, Q. Li, X. Niu, B. Hu, J. Liu, Zhou S-m, et al., Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice , Stem Cell Res. Ther. 6 (2015) 1–15.
- J. Zhang, J. Guan, X. Niu, G. Hu, S. Guo, Q. Li, et al., Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis , J. Transl. Med. 13 (2015) 1–14.
- B. Zhang, M. Wang, A. Gong, X. Zhang, X. Wu, Y. Zhu, et al., HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing, Stem Cells 33 (2015) 2158–2168.
- B. Zhang, Y. Yin, R.C. Lai, S.S. Tan, A.B.H. Choo, S.K. Lim, Mesenchymal stem cells secrete immunologically active exosomes , Stem Cells Dev. 23 (2013) 1233–1244.
- C.Y. Tan, R.C. Lai, W. Wong, Y.Y. Dan, S.-K. Lim, H.K. Ho, Mesenchymal stem cell-derived exosomes promote hepatic regeneration in drug-induced liver injury models , Stem Cell Res. Ther. 5 (2014) 1–14.
- C. Lee, S.A. Mitsialis, M. Aslam, S.H. Vitali, E. Vergadi, G. Konstantinou, et al., Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension , Circulation 126 (2012) 2601–2611.
- B. Yu, H. Shao, C. Su, Y. Jiang, X. Chen, L. Bai, et al., Exosomes derived from MSCs ameliorate retinal laser injury partially by inhibition of MCP-1 , Sci. Rep. 6 (2016) 34562.
- Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof of concept clinical trial. Stem Cells. 2014;32(5):1254–66.
- Vega, Aurelio, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681–90.
- Davatchi F, Sadeghi-Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis. Preliminary report of four patients. Int J Rheum Dis. 2011;14(2):211–5
- Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case- controlled study. Int Orthop. 2014;38(9):1811–1818
- Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives. Biomed Res Int. 2014;2014:6.
- Beitzel K, Solovyova O, Cote MP, et al. The future role of mesenchymal Stem cells in The management of shoulder disorders . Arthroscopy. 2013;29(10):1702–1711.
- Isaac C, Gharaibeh B, Witt M, Wright VJ, Huard J. Biologic approaches to enhance rotator cuff healing after injury. J Shoulder Elbow Surg. 2012;21(2):181–190.
- Malda, Jos, et al. " Extracellular vesicles [mdash] new tool for joint repair and regeneration. " Nature Reviews Rheumatology (2016).
Weiterführende Literatur zu PRP
- Rubio-Azpeitia E, Andia I. Partnership between platelet-rich plasma and mesenchymal stem cells: in vitro experience. Muscles Ligaments Tendons J. 2014;4(1):52–62.
Extras
- Xu, Ming, et al. " Transplanted senescent cells induce an osteoarthritis-like condition in mice. " The Journals of Gerontology Series A: Biological Sciences and Medical Sciences (2016): glw154.
- McCulloch, Kendal, Gary J. Litherland, and Taranjit Singh Rai. " Cellular senescence in osteoarthritis pathology ." Aging Cell (2017).
Patienten-Services des ANOVA Institute for Regenerative Medicine
- Das Institut liegt in Offenbach am Main, im Herzen Deutschlands, weniger als 20 Minuten vom Frankfurter Flughafen entfernt
- Individualisierte Therapie mit innovativen Stammzellprodukten
- Individuell geplante diagnostische Untersuchungen mit modernen MR- und CT-Geräten und Blutuntersuchungen
- Deutscher Qualitätsstandard (100% made in Germany) für Produktsicherheit und Qualitätssicherung
- Persönlicher Service mit freundlichen, engagierten Patientenbetreuern und Krankenschwestern
- Stetiger wissenschaftlicher Austausch mit akademischen Einrichtungen, um Ihnen die innovativsten Behandlungen im Bereich regenerative Medizin anbieten zu können