Stammzellen-Behandlungsprogramm für erektile Dysfunktion
Erektile Dysfunktion (ED) ist ein Problem, das ca. 50% aller Männer im Alter zwischen 40 und 70 Jahren betrifft. ED ist definiert als die Unfähigkeit, eine für den Geschlechtsverkehr ausreichende Erektion des Penis zu haben.
In etwa 80 % der Fälle lässt sich eine körperliche Ursache feststellen, darunter Herz-Kreislauf-Erkrankungen, Diabetes mellitus, Nebenwirkungen von Medikamenten und neurologische Probleme, die nach einer chirurgischen Entfernung der Prostata oder ähnlichen Eingriffen auftreten können. Von psychischer Impotenz sprechen Mediziner, wenn eine Erektion oder Penetration aufgrund von Gedanken oder Gefühlen nicht möglich oder beeinträchtigt ist; dieses Problem tritt bei ca. 10% aller ED-Fälle auf.
Auf dieser Seite informieren wir Sie über erektile Dysfunktion mit einem Überblick über wichtige Aspekte der Ursachen, Behandlungsmöglichkeiten, Präzisionsdiagnostik sowie über unsere stammzellbasierten Therapien, die wir anbieten.
Springen Sie direkt zu den folgenden Themen:
Wie behandeln wir? Individuelle Behandlungskonzepte
Alle Therapiekonzepte der ANOVA sind individuell auf Sie als Patienten zugeschnitten. Wir berücksichtigen Ihre Vorgeschichte, Ihre Wünsche und Ihren spezifischen Krankheitsverlauf. Je nach Art und Schwere des Defekts sowie akuter oder chronischer Ursache, stellen wir Ihnen einen optimalen Behandlungsplan zusammen. Dieser kann eine einmalige Behandlung oder eine mehrfache Stammzellbehandlung sowie weitere Therapieformen beinhalten. Folgende Therapieformen wenden wir bei Knieverletzungen an:
Stammzellentherapien bei Erektiler Dysfunktion
ANOVA Institute for Regenerative Medicine - Offenbach, Deutschland
Secretome/Exosomen
Potenzhypothese der Stammzellentherapien
Stammzellen besitzen das Potenzial, mit den Immunzellen zu kommunizieren, die die Entzündung hervorrufen, und können auf natürliche, bisher nicht verstandene Weise eine immunüberreaktion hemmen. Darüber hinaus haben Stammzellen die Fähigkeit, die Regeneration von Gewebe zu stimulieren und somit dem Funktionsverlust entgegenzuwirken.
In den letzten Jahren hat sich besonders im urologischen Bereich eine besondere Begeisterung für stammzellbasierte Therapien entwickelt, insbesondere für die Behandlung der erektilen Dysfunktion. Mehrere präklinische Studien haben die Anwendung von Stammzellen für urologische Erkrankungen erforscht, insbesondere Knochenmarkstammzellen (BMSC) und aus Fett gewonnene Stammzellen (ADSC) zur Behandlung von ED in Tiermodellen, wie von Soebadi et al. 2016 zusammengefasst.
Bei akuter ED wird angenommen, dass der Reparaturmechanismus, den Stammzellen bewirken, auf parakriner Ebene liegt. Bei chronischer ED basiert die Wirkung von Stammzellen jedoch möglicherweise hauptsächlich auf Engraftment und zellulärer Differenzierung. Der genaue Mechanismus, wie Stammzellen die erektile Funktion bei chronischer ED verbessern, ist noch nicht vollständig gelöst.
MSEC - Mesenchymale Stammzell-Secretome - Exosomen - Autolog
Patienten mit einer langen Vorgeschichte von ED-Symptomen werden in der Regel mit MSEC (Secretome, Exosomen, EVs) von mesenchymalen Stammzellen (MSC, AD-MSC, aus Fett gewonnene Stammzellen) behandelt, die wir dem Bauch der Patienten bei einer Mini-Fettabsaugung (sehr kurze und begrenzte Fettabsaugung) unter leichter Sedierung entnehmen. Weltweit ist ANOVA die erste Stammzellklinik, die die rechtliche Genehmigung der zuständigen staatlichen Behörden erhalten hat und somit hochwertige, sichere und rechtlich kontrollierte autologe (eigene) Exosom-enthaltende Secretome anbietet.
Der Hauptvorteil von MSEC besteht darin, dass im Gegensatz zu lebenden Stammzellen, die ihre therapeutische Potenz verlieren würden, Exosomen ohne Verlust eingefroren werden können. Dies ermöglicht uns die Herstellung von 10-20 Injektionsdosen aus einer Fettabsaugung, die dann über einen längeren Behandlungszeitraum verabreicht werden können. Dies ist besonders vorteilhaft für die langfristige Stimulation der Regeneration bei ED.
Was ein Secretome/Exosom ist und wie sie sich vergleichen, wird auf unserer Übersichtsseite erläutert.
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben Sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
ED Konventionelle Behandlungen - Medikamente – Diagnostik
Zwar profitieren heutzutage viele Männer, die an ED leiden, von einer Behandlung mit Medikamenten auf PDE5I-Basis (Phosphodiesterase-Typ-5-Hemmer) wie Viagra oder Cialis, doch können diese Medikamente unangenehme Nebenwirkungen haben, sind bei manchen Patienten kontraindiziert und bringen nicht immer die gewünschten Ergebnisse.
Andere Behandlungsmöglichkeiten für ED sind Injektionen in den Penis oder die Harnröhre, Vakuum-Erektionshilfen und die Implantation einer Penisprothese. Diese Optionen werden von den meisten Männern als unerwünscht angesehen, da sie zu invasiv und künstlich sind und zu unbefriedigenden Ergebnissen führen.
Alle diese Methoden behandeln lediglich die Symptome der ED, heilen aber nicht den zugrunde liegenden Krankheitsprozess. Dies könnte sich nun mit der Verfügbarkeit von Therapien auf Stammzellenbasis ändern.
Physiologie der Erektion und Ursachen erektiler Dysfunktion
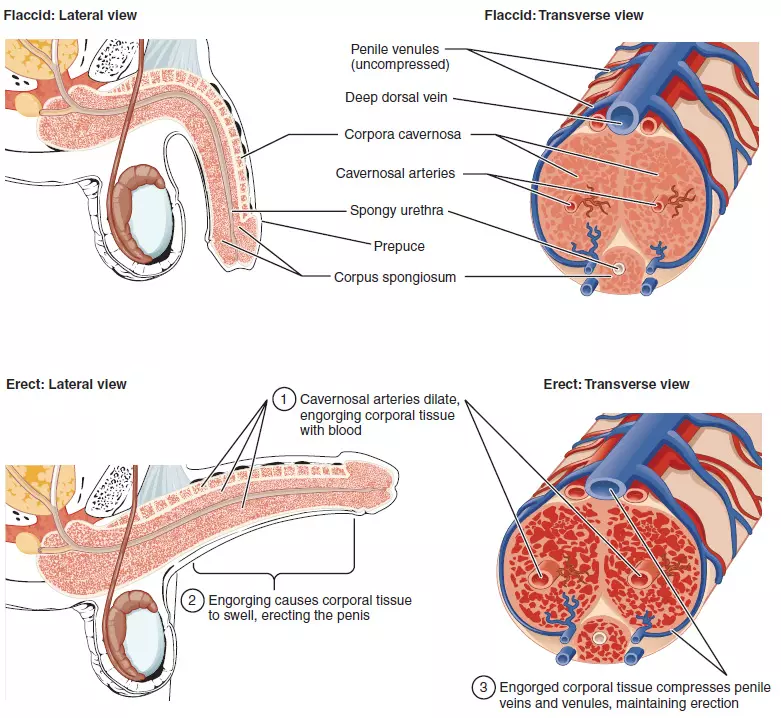
Die Erektion des Penis wird erreicht, indem sich die Schwellkörper des Penis mit Blut füllen. Ausgelöst durch psychologische Reize werden Nervensignale vom Gehirn über das Rückenmark an die peripheren Nerven gesendet, die dann in den Schwellkörpern Stickstoffmonoxid (NO, ein Signalmolekül) freisetzen. NO bewirkt, dass sich die glatte Muskulatur der Schwellkörper über die Freisetzung von cGMP (zyklisches Guanosinmonophosphat, ein so genannter Second Messenger, ein sekundäres Signalmolekül innerhalb der Zellen) entspannt und sich mit Blut vollsaugt. Dies ist die auslösende Phase einer Erektion, die eine normale Funktion der Nerven voraussetzt.
Durch die Vergrößerung der Schwellkörper werden die ableitenden Venen zwischen den Schwellkörpern und der Tunica albuginea des Penis zusammengedrückt, was zu einem Verschluss des venösen Abflusses und einer vollständigen Erektion führt. Dies ist die mechanische Phase der Erektion.
Die Erschlaffung des Penis tritt ein, wenn der Botenstoff cGMP durch ein Enzym, die so genannte Typ-5-Phosphodiesterase, abgebaut wird, was zu einer Kontraktion der glatten Muskulatur der Schwellkörper führt, was einen verminderten Blutzufluss, eine Verkleinerung der Schwellkörper und eine Dekompression der Venen zur Folge hat, was den Abfluss des Blutes aus den Schwellkörpern bewirkt. Die wichtigsten Komponenten einer Erektion sind die Endothelzellen (EC) und die glatten Muskelzellen der Schwellkörper (CSMC) sowie die Freisetzung von NO durch die Schwellkörpernerven (CN).
Alterung und eine Vielzahl von Krankheiten können diese wesentlichen anatomischen und physiologischen Komponenten verändern, was zu ED führt. Nach einer radikalen Prostatektomie (RPE, vollständige Entfernung der Prostata), der Standardbehandlung bei Prostatakrebs, können die Schwellkörpernerven geschädigt werden. Während die unmittelbar daraus resultierende neurogene ED reversibel sein kann, können die langfristigen Folgen, wie eine verminderte NO-Produktion und das Absterben der glatten Muskelzellen der Schwellkörper, zu einer Atrophie und Fibrose der Schwellkörper führen und eine dauerhafte ED zur Folge haben. Ein hoher Blutzuckerspiegel bei Diabetes mellitus sowie ein erhöhter Cholesterinspiegel und eine Hyperlipidämie können durch ähnliche Mechanismen ebenfalls zu ED führen.
ED-Diagnostik bei ANOVA IRM - Ursache und Stadium ermitteln
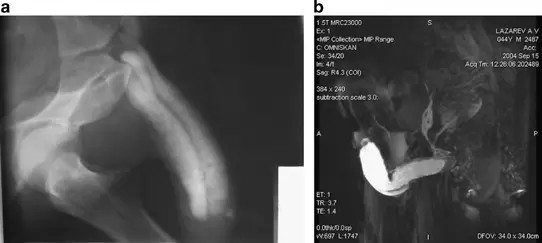
Erektile Dysfunktion - Diagnostik:
Ein 43-jähriger Patient: (a) Die Pharmakokavernosographie zeigt kein deutliches venöses Leck. (b) MRT: Deutliches venöses Leck (gemischter Typ) mit kavernobalanischem Shunt wird sichtbar. ANOVA IRM – Deutschland
Da es viele Ursachen für ED gibt, ist eine umfassende Diagnostik erforderlich, um das Problem und damit die richtige Behandlung zu finden. Bei ANOVA führen wir die folgenden Tests durch:
- ED-Fragebogen zur Beurteilung des allgemeinen Gesundheitszustands und spezifischer Probleme
- Körperliche Untersuchung durch einen Urologen/Andrologen
- Umfassende Blutuntersuchung einschließlich Hormonwerte (Testosteron, etc.)
- Ultraschalluntersuchung des Penis und der Arterien des Penis (Doppler- und Duplex-US)
- Magnetresonanztomographie (MRI) und Angiographie (MRA) der den Penis versorgenden Arterien
Lesen Sie weiter unten mehr über die Diagnostik von ED.
Stammzellbehandlungen für Erektionsstörungen bei ANOVA IRM
Sekretome/Exosomen
Therapie-Workflow bei erektiler Dysfunktion
Der genaue Ablauf ist auf den stammzellspezifischen Seiten von BMC (am häufigsten bei OA eingesetzt), Secretome/Exosomen und PRP (als Kombinationstherapie) detailliert beschrieben.
Alle Therapien gliedern sich in Phasen wie Auswertung der Anamnese (wir analysieren Ihre aktuellen Therapien und Krankenakten), Erstberatung und Bewertung des möglichen, patientenindividuellen Nutzens einer Stammzelltherapie (Indikationsstellung), Voruntersuchungen, Diagnostik, Beratung zu allen Therapieoptionen, Erstellung eines individuellen Behandlungsplans inklusive Kostenvoranschlag, Gewebeentnahme, Herstellung des Stammzellprodukts, Qualitätskontrolle des Produkts und Anwendung. Für Arthrose- und Arthritispatienten gibt es zwei Besonderheiten. Wenn Ihre bisherigen Befunde die spezifischen Ursachen Ihrer Gelenkschmerzen nicht gefunden haben, untersuchen wir Sie vorab mit einem präzisen und aussagekräftigen Arthro-MRT oder einem MRT mit nicht radioaktivem Kontrastmittel, wenn Sie dies wünschen. Darüber hinaus applizieren wir die Stammzellen (BMC) häufig intraartikulär (d. h. direkt im Gelenk). Das bedeutet, dass wir die Stammzellen genau an den Ort bringen, an dem Ihre Schmerzen entstehen.
Wie lange dauert eine Stammzellentherapie?
Die ersten Analysen und Beratungen können durchgeführt werden, ohne dass Sie nach Offenbach reisen müssen. Dieser Zeitraum kann je nach Verfügbarkeit von Patientenplätzen 2 Wochen bis zu Monaten betragen. Wenn Sie weiter weg wohnen, werden wir die Erstgespräche per Telefon oder Videokonferenz führen. Für die eigentliche Behandlung reisen Sie nach Offenbach. Je nach Therapie, Gewebeentnahme, Qualitätskontrolle und Behandlungsart dauert es dann wie folgt:
BMC- und PRP-Behandlung
Jede Spende und Anwendung von BMC vor Ort: 2 aufeinanderfolgende Tage.
Sekretome/Exosome-Therapie:
Aufbereitung und Entnahme des Fettes (Mini-Liposuktion) benötigen einmalig 2 Tage (aufeinanderfolgende Tage) in Offenbach, gefolgt von Anreicherung der mesenchymalen Stammzellen (Sekretom/Exosom) und Qualitätskontrolle. Ca. 4 Wochen nach der Isolierung beginnt die Therapie nach dem mit Ihnen festgelegten Therapieplan. Sie kommen dann mehrmals nach Offenbach am Main (Deutschland) zur Anwendung. Die Haltbarkeit der Sekretome (Exosomen) beträgt 2 Jahre.
Wie viel kostet eine Stammzellbehandlung?
Unsere Behandlungen sind immer auf Ihre spezielle Situation, Ihre Erkrankung, Ihr Stadium und andere Faktoren zugeschnitten. Die Therapien unterscheiden sich durch das verwendete Produkt (BMC, Sekretom, PRP oder Hyaluronsäure), die Häufigkeit der Behandlung sowie die weiteren Untersuchungen und Ihre Sedierungs- und Anästhesiewünsche. Eine Behandlung der erektilen Dysfunktion kann zwischen einigen tausend und mehreren tausend Euro kosten. Für alle Behandlungen erhalten Sie vorab einen Kostenvoranschlag, damit Sie genau abschätzen können, was eine Behandlung in Ihrem individuellen Fall kosten würde.
Übernimmt meine Krankenkasse die Therapiekosten?
Leider wird derzeit davon ausgegangen, dass die Krankenkassen die Kosten für experimentelle Therapien (BMC, Sekretom, PRP) nicht übernehmen, d.h. Sie müssen die Kosten vollständig selbst tragen.
Wie unterscheidet sich die ANOVA-Therapie?
Diagnostik - Wir suchen nach der Ursache für Ihr Problem
Dr. mult. Michael K. Stehling, der Gründer von ANOVA IRM und dem Vitus Prostata Zentrum, ist Radiologe und promovierter Physiker. Aus diesem Grund verfügt das ANOVA Institut für Regenerative Medizin in Zusammenarbeit mit dem im gleichen Haus ansässigen Institut für Bildgebende Diagnostik Prof. Stehling über die Möglichkeit einer speziellen Präzisionsdiagnostik, wie z.B. die Ultraschalluntersuchung des Penis und der Penisarterien (Doppler- und Duplex-US) sowie die Magnetresonanztomographie (MRT) und Angiographie (MRA) der penisversorgenden Arterien.
Diagnostische Überlegungen:
Für eine individuelle, patientenspezifische und erfolgreiche Behandlung der ED ist eine gründliche diagnostische Untersuchung erforderlich, um die Ursache und das Stadium der ED zu ermitteln und andere Erkrankungen als auslösende Faktoren auszuschließen.
Bedingungen, die zu berücksichtigen sind:
- Krebs und Krebsbehandlung
- Hypogonadismus
- Leistungsangst
- Medikamente
- Antidepressiva
- Antipsychotika
- Antihypertensiva
- Medikamente gegen Magengeschwüre
- Hyperlipidämie-Medikamente
Differenzialdiagnosen:
- Abdominale Gefäßverletzungen
- Depressionen
- Diabetes mellitus Typ 2
- Hämochromatose
- Bluthochdruck
- Hypogonadismus
- Hypopituitarismus (Panhypopituitarismus)
- Nicht-koronare Atherosklerose
Laboruntersuchung für erektile Dysfunktion:
- Hämoglobin A1c
- Serumchemisches Panel
- Lipidprofil
- Urinuntersuchung
- Rote Blutkörperchen (RBCs)
- Weiße Blutkörperchen (WBCs)
- Eiweiß
- Glukose
Auswertung des Hormonstatus:
- Morning serum testosterone levels (testosterone levels peak at approximately 8 am)
- Measuring total, free, and bioavailable testosterone levels and serum Hormone–binding globulin
- Luteinizing hormone (LH)
- Follicle stimulating hormone (FSH)
- Prolactin
- Thyroid-stimulating hormone (TSH)
Wie unterscheidet sich die ANOVA-Therapie?
Wir implantieren die Stammzellen genau dort, wo sie benötigt werden Aufgrund unserer spezifischen Diagnostik mittels Ultraschalluntersuchung des Penis und der Penisarterien (Doppler- und Duplex-US) sowie Magnetresonanztomographie (MRT) und Angiographie (MRA) der den Penis versorgenden Arterien können wir im Gegensatz zu vielen anderen Kliniken die Stammzellen bildgestützt, z.B. mittels CT, genau an die betroffene Stelle bringen. So können wir in und an den Ort der Schädigung oder Ursache injizieren, um dort gezielt und schnell eine Wirkung auszulösen. Alle Eingriffe werden unter Aufsicht und Betreuung unseres Anästhesisten durchgeführt und sind schmerzfrei.
Eine rein intravenöse Verabreichung, wie es viele andere Kliniken tun, wird bei den Sekretomen (Exosomen) nur dann durchgeführt, wenn diese zusätzlich als unterstützende oder präventive Maßnahme eingesetzt werden sollen, da Gelenkprobleme an mehreren Stellen im Körper vorhanden sind, da die Sekretome die Immunantwort zentral modulieren sollen, um Überreaktionen zu verhindern.
Selbstverständlich werden wir Sie im Vorfeld und in der Vor-Ort-Sprechstunde ausführlich über alle Schritte beraten und Alternativen und Erwartungen besprechen.
Sichere Methoden zur Verabreichung von Stammzellen bei erektiler Dysfunktion
Es gibt verschiedene Methoden der Anwendung. Es hat sich gezeigt, dass die intravenöse Injektion von ADSCs die Erektionsfähigkeit verbessert. Die Injektion von Stammzellen in die Schwellkörper des Penis (intrakorporal) ist ebenfalls angewandt worden, da sie sowohl einfach ist als auch logisch erscheint. Die periprostatische Injektion, mit oder ohne gleichzeitige intrakorporale Injektion, ist ebenfalls durchgeführt worden. Alle diese Applikationsformen können potenziell hilfreich sein, da die regenerative Wirkung der Stammzellen hauptsächlich entweder indirekt durch die lokale Sekretion von Wachstumsfaktoren über parakrine Mechanismen oder durch die direkte Migration der Zellen zu den großen Beckenganglien erzielt wird.
Die Sicherheit, Wirksamkeit und die Mechanismen von Stammzellen aus Knochenmark (BM) und Fettgewebe (ADSC) für die Behandlung von ED wurden in mehreren vorklinischen Versuchen eingehend untersucht. Eine Forschergruppe hat die Daten zusammengefasst Ref.
Fast alle Studien berichteten über eine Verbesserung der erektilen Funktion in verschiedenen Tiermodellen von ZNS-Verletzungen, Gefäßinsuffizienz, Diabetes mellitus, Hyperlipidämie und Alterung. Zwar bestehen bei der Transplantation von Stammzellen nach wie vor Bedenken hinsichtlich der möglichen Förderung bösartiger Tumore, doch hat die Verwendung zellfreier Lösungen wie das ANOVA-Stammzellsekretom, die Sammlung parakriner Faktoren, mit denen Stammzellen die Reparatur bewirken, dieses Problem gelöst, da die Transplantation der eigentlichen Stammzellen vermieden wird.
Sie sind interessiert, aber unsicher?
Möchten Sie eine zweite medizinische Meinung einholen? Vereinbaren Sie einen Beratungstermin!
Wir bieten auch einen Service für eine zweite Meinung zu Ihren aktuellen medizinischen Unterlagen (MRT, CT, Röntgen) und Behandlungsempfehlungen. Unsere Patientenbetreuer informieren Sie gerne darüber, welche Informationen wir im Vorfeld benötigen, wie Sie große Dateien übertragen können und vereinbaren für Sie einen Beratungstermin mit unseren Ärzten. Bitte nutzen Sie unser Kontaktformular, um eine schnelle Bearbeitung Ihres Falles und Ihrer Anfrage zu unterstützen.
Sie können uns auch gerne eine E-Mail zu Ihrem Fall schicken. Der Beratungstermin kann auch per Telefon oder Videochat stattfinden, wenn Sie außerhalb Deutschlands wohnen. Für eine intensivere Beratung oder zusätzliche diagnostische Abklärungen können Sie auch einen Vor-Ort-Termin buchen. Erforderliche MRT-Untersuchungen können wir noch am selben Tag durchführen. Alle von unserem Patientenbetreuungsteam erbrachten Dienstleistungen sind kostenlos, und wir informieren Sie im Voraus über alle Kosten für Arzttermine.
Patientenmeinungen: Ryan Donovan - Erektile Dysfunktion - BMC Behandlung
"Ich bin ein 30 Jahre alter Mann. Ich habe immer Sport getrieben, um meinen Körper gesund zu halten, und ich ernähre mich ausgewogen. Leider erlitt ich vor drei Jahren ein lokales Trauma, das bei mir zu einer gewissen erektilen Dysfunktion führte. Nachdem ich konventionelle Therapien ausprobiert hatte, wandte ich mich an ANOVA, um zu versuchen, einen kurativen - und nicht nur palliativen - Ansatz für meinen Zustand zu finden. Ich muss Herrn Martinovic und dem gesamten ANOVA-Team danken, die meinen Fall vom ersten Kontakt an mit Diskretion und Würde behandelt haben. Frau Dr. Sabow, bei der ich das ärztliche Gespräch und später den Eingriff hatte, war außerordentlich kompetent und professionell. Sie gab mir eine realistische Beschreibung der Ergebnisse, die ich von der von mir gewählten Therapie (BMC für erektile Dysfunktion) zu erwarten hatte. Die Klinik ist modern, und das gesamte Team ist sehr kompetent. Der Eingriff verlief reibungslos, und 3 Monate später kann ich mich über messbare Verbesserungen meines Zustands und meiner Lebensqualität freuen."
Ryan Donovan ( Aus dem Englischen übersetzt )
Mit Stammzelltherapie die Ursache von ED bekämpfen
Trotz des breiten Spektrums an Ursachen für ED besteht der gemeinsame Nenner darin, dass es bisher nur Möglichkeiten zur Behandlung der Symptome gab. Typische Medikamente zur Behandlung der Erektilen Dysfunktion (ED) und der Impotenz basieren auf einer Substanzgruppe namens "PDE-5-Hemmer". Viele andere Medikamente haben in Form von Injektionen oder Cremes eine zeitlich begrenzte Hilfe gegen Impotenz gezeigt. Es gibt keine eindeutige Antwort darauf, welches dieser ED-Behandlungsmittel das beste ist, da sie unterschiedliche Eigenschaften und Nebenwirkungen haben. Alle diese Medikamente haben jedoch eines gemeinsam: Sie setzen nicht an der Ursache an und sind daher keine "Heilmittel". Ihre Wirkungsweise beruht auf der vorübergehenden Überwindung der Symptome einer schwachen oder fehlenden Erektion.
Die regenerative Medizin und die Verwendung von Stammzellen als eines ihrer wichtigsten Instrumente bei der Behandlung zahlreicher Erkrankungen ermöglichen uns einen grundlegend anderen Behandlungsansatz. Alle Ursachen für erektile Dysfunktion, mit Ausnahme der psychisch bedingten Impotenz, haben eine Form von primärem oder sekundärem Blut- oder Nervenversorgungsproblem als Hauptursache. Regenerative Therapien auf der Grundlage von Stammzellen haben das Potenzial, sowohl die Angiogenese (neues Wachstum von Blutgefäßen und Verbesserung der Blutversorgung) als auch die Neurotrophie/Neuroprotektion (neues Wachstum und Schutz der Nervenversorgung des Penis) zu fördern.
Es gibt zwar einige Ursachen für ED, die nicht behandelt werden können (z. B. psychisch bedingte ED), aber die neuen Entdeckungen in der regenerativen Medizin und bei den Stammzellen können möglicherweise eine Lösung bieten. Es sollte jedoch beachtet werden, dass ein Therapieerfolg bei keiner Art von Behandlung garantiert werden kann. Insbesondere bei experimentellen Behandlungen wie der Stammzelltherapie ist der behandelnde Arzt verpflichtet, für jeden Patienten eine Nutzen-Risiko-Analyse durchzuführen und sowohl den Nutzen als auch die Risiken für den jeweiligen Patienten zu ermitteln. Wenn der potenzielle Nutzen die möglichen Nebenwirkungen überwiegt, kann er die experimentelle Therapie empfehlen. Informieren Sie sich über Ihre Therapiemöglichkeiten bei ANOVA - rufen Sie uns noch heute an.
Personalisierte Behandlung der erektilen Dysfunktion bei ANOVA IRM
Potenzschwäche, Impotenz und erektile Dysfunktion haben eine Vielzahl von möglichen Ursachen. Eine gute medizinische Beurteilung und Diagnose ist absolut unerlässlich, bevor ein individueller Behandlungsplan für Ihre erektile Dysfunktion erstellt wird. In den seltensten Fällen wird eine einzige Injektion von Stammzellen aus dem Zufallsprinzip Ihre Erektionsprobleme adäquat behandeln. ANOVA arbeitet eng mit einer voll ausgestatteten Klinik für Bilddiagnostik zusammen, die über mehrere MRT-Scanner, CT, Ultraschall und modernste Bluttests verfügt und in der Ärzte verschiedener Fachrichtungen arbeiten. Wir analysieren die Ursache Ihres Potenz- oder ED-Problems und erstellen einen auf Ihr Problem abgestimmten Behandlungsplan. Bewährte Leitlinienmethoden, Medikamente, Ernährungs- und Lebensstilempfehlungen werden in Ihren Behandlungsplan aufgenommen - zusammen mit modernsten und sicheren Therapien auf Stammzellenbasis.
Häufig gestellte Fragen:
Stammzellbasierte Behandlungen und regenerative Therapien für Erektionsstörungen?
Was ist Erektile Dysfunktion/Impotenz?
Erektile Dysfunktionen (ED) werden als Verminderung der Potenz und Libido definiert. Männer aller Altersgruppen können unter schwachen Peniserektionen leiden, was den Geschlechtsverkehr problematisch oder sogar unmöglich macht.
Was verursacht Erektile Dysfunktion - ED?
Es kann eine Vielzahl von Ursachen haben, sowohl physische als auch psychische. Die häufigsten Gründe sind Diabetes, Rauchen, Fettleibigkeit oder Bluthochdruck. Auch die Auswirkungen des Alterns sind teilweise für Impotenz und ED verantwortlich.
Wie wird die erektile Dysfunktion (ED) behandelt? Welche Medikamente werden zur Behandlung von ED eingesetzt?
In den vergangenen zehn Jahren haben sich die so genannten PDE-5-Hemmer" als eine erfolgreiche Medikamentengruppe erwiesen, die die Lebensqualität vieler betroffener Männer verbessert hat. Sie bieten jedoch nur eine begrenzte Hilfe, indem sie die Symptome von Impotenz und ED vorübergehend außer Kraft setzen. Mit den jüngsten Fortschritten in der Stammzellenforschung haben sich vielversprechende Behandlungsmöglichkeiten ergeben. Wir von ANOVA, einer deutschen Stammzellklinik, sind die ersten in Europa, die einen neuartigen stammzellbasierten medizinischen Behandlungsansatz zur Behandlung von Impotenz vorstellen: Das ANOVA-Stammzellsekretom. Vereinbaren Sie noch heute einen Termin und erfahren Sie mehr darüber, wie wir ED mit stammzellbasierten Therapien behandeln.
Was sind Stammzellen?
Stammzellen sind Zellen, die die Fähigkeit besitzen, sich in viele Untergruppen von Zellen zu teilen, und die durch ihre parakrine Kommunikation (Wachstumsfaktoren, Hormone, Zytokine, entzündungshemmende Faktoren, extrazelluläre Vesikel, Exosomen und microRNA) für viele Kontrollfunktionen im Körper verantwortlich sind. Hier finden Sie einen ausführlichen Artikel, der einige der medizinisch relevanten Eigenschaften von Stammzellen und aus Stammzellen gewonnenen Behandlungen beschreibt.
Wurde bereits Forschung zu Stammzellen und ED betrieben?
Seit 2004 wurden bisher über 20 präklinische Studien zu verschiedenen Stammzellmodellen und verschiedenen Schadensmodellen bei Tieren für ED veröffentlicht. Im Jahr 2016 wurden zwei Phase-I-Studienergebnisse zu Knochenmarkskonzentrat (BMC) und aus Fett gewonnenen mesenchymalen Stammzellen (adMSCs) veröffentlicht. Sowohl die Human- als auch die Tierstudien zeigten durchweg eine Verbesserung, wobei die Ergebnisse unterschiedlich interpretiert wurden. Eine bahnbrechende Studie wurde 2010 von Albersen et al. veröffentlicht, die zeigte, dass die Wirkung von Stammzellinjektionen nicht auf die direkte Differenzierung und Adhärenz der injizierten Stammzellen zurückzuführen ist, sondern vielmehr auf deren parakrine Substanzen.
Funktioniert die Stammzelltherapie bei Erektionsstörungen - ED?
Die ANOVA Stammzell-Sekretom-Therapie als nächste Generation von stammzellbasierten Therapien beinhaltet parakrine Substanzen, die das Potenzial haben, die Regeneration zu stimulieren. Damit bietet sie einen neuen Ansatz für die Behandlung von erektiler Dysfunktion und Impotenz. Wir sind die Ersten in Europa, die die Vorteile der Stammzellen voll ausschöpfen und ihre Regenerationskraft über die von ihnen ausgeschiedenen Biostoffe nutzbar machen. Mit der ANOVA Secretome Therapy in Kombination mit Stammzellen aus Knochenmarkskonzentrat können wir einen sicheren Weg bieten, um Stammzellen als natürliche, persönlich zugeschnittene, regenerative Therapie für die verschiedenen zugrunde liegenden Pathologien der erektilen Dysfunktion und Impotenz zu nutzen.
Referenzen
- Nitti, Victor W (2001). "The Prevalence of Urinary Incontinence". Reviews in Urology. 3 (Suppl 1): S2–S6. ISSN 1523-6161. PMC 1476070. PMID 16985992.
- Subak, Leslee L.; Richter, Holly E.; Hunskaar, Steinar (December 2009). "Obesity and urinary incontinence: epidemiology and clinical research update". The Journal of Urology. 182 (6 Suppl): S2–7. doi:10.1016/j.juro.2009.08.071. ISSN 1527-3792. PMC 2866035. PMID 19846133.
- Rortveit, G.; Hannestad, Y. S.; Daltveit, A. K.; Hunskaar, S. (December 2001). "Age- and type-dependent effects of parity on urinary incontinence: the Norwegian EPINCONT study". Obstetrics and Gynecology. 98 (6): 1004–1010. doi:10.1016/s0029-7844(01)01566-6. ISSN 0029-7844. PMID 11755545. S2CID 20932466.
- Lukacz, Emily S.; Lawrence, Jean M.; Contreras, Richard; Nager, Charles W.; Luber, Karl M. (June 2006). "Parity, mode of delivery, and pelvic floor disorders". Obstetrics and Gynecology. 107 (6): 1253–1260. doi:10.1097/01.AOG.0000218096.54169.34. ISSN 0029-7844. PMID 16738149. S2CID 1399950.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4294800/
- Macura KJ, Genadry RR, Bluemke DA. MR Imaging of the Female Urethra and Supporting Ligaments in Assessment of Urinary Incontinence: Spectrum of Abnormalities. RadioGraphics 2006; 26:1135–1149.
- Amend B, Stenzl A. Aktuelle Therapiemöglichkeiten für die komplizierte Belastungsharninkonntinenz bei Frauen. Uroforum 2021;9:32-34.
- Klein G, Hart ML, Brichmann A, et al. Mesenchymal stromal cells for sphincter regeneration. Adv Drug Deliv Rev. 2015;82-83:123-136
Weiterführende Literatur zu MSC, BMC, Stamzellen Secretom und EVs
- Georg Hansmann, Philippe Chouvarine, Franziska Diekmann, Martin Giera, Markus Ralser, Michael Mülleder, Constantin von Kaisenberg, Harald Bertram, Ekaterina Legchenko & Ralf Hass "Human umbilical cord mesenchymal stem cell-derived treatment of severe pulmonary arterial hypertension". Nature Cardiovascular Research volume 1, pages568–576 (2022).
- Murphy JM, Fink DJ, Hunziker EB, et al. Stem cell therapy in a caprine model of osteoarthritis . Arthritis Rheum. 2003;48:3464–74.
- Lee KB, Hui JH, Song IC, Ardany L, et al. Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model. Stem Cell. 2007;25:2964–71.
- Saw KY, Hussin P, Loke SC, et al. Articular cartilage regeneration with autologous marrow aspirate and hyaluronic acid: an experimental study in a goat model. Arthroscopy . 2009;25(12):1391–400.
- Black L, Gaynor J, Adams C, et al. Effect of intra-articular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Vet Ther. 2008;9:192-200.
- Centeno C, Busse D, Kisiday J, et al. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells. Pain Physician. 2008;11(3):343–53.
- Centeno C, Kisiday J, Freeman M, et al. Partial regeneration of the human hip via autologous bone marrow nucleated cell transfer: a case study. Pain Physician. 2006;9:253–6.
- Centeno C, Schultz J, Cheever M. Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique. Curr Stem Cell. 2011;5(1):81–93.
- Pak J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose derived stem cells: a case series. J Med Case Rep. 2001;5:296.
- Kuroda R, Ishida K, et al. Treatment of a full-thickness articular cartilage defect in the femoral condyle of an athlete with autologous bone-marrow stromal cells. Osteoarthritis Cartilage. 2007;15:226–31.
- Emadedin M, Aghdami N, Taghiyar L, et al. Intra-articular injection of autologous mesenchymal stem cells in six patients with knee osteoarthritis. Arch Iran Med. 2012;15(7):422–8.
- Saw KY et al. Articular cartilage regeneration with autologous peripheral blood stem cells versus hyaluronic acid: a randomized controlled trial. Arthroscopy. 2013;29(4):684–94.
- Vangsness CT, Farr J, Boyd J, et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy. J Bone Joint Surg. 2014;96(2):90–8.
- Freitag, Julien, et al. Mesenchymal stem cell therapy in the treatment of osteoarthritis: reparative pathways, safety and efficacy–a review. BMC musculoskeletal disorders 17.1 (2016): 230.
- Maumus, Marie, Christian Jorgensen, and Danièle Noël. " Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. " Biochimie 95.12 (2013): 2229-2234.
- Dostert, Gabriel, et al. " How do mesenchymal stem cells influence or are influenced by microenvironment through extracellular vesicles communication?. " Frontiers in Cell and Developmental Biology 5 (2017).
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- Toh, Wei Seong, et al. " MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. " Seminars in Cell & Developmental Biology. Academic Press, 2016.
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- S. Koelling, J. Kruegel, M. Irmer, J.R. Path, B. Sadowski, X. Miro, et al., Migratory chondrogenic progenitor cells from repair tissue during the later stages of human osteoarthritis , Cell Stem Cell 4 (2009) 324–335.
- B.A. Jones, M. Pei, Synovium-Derived stem cells: a tissue-Specific stem cell for cartilage engineering and regeneration , Tissue Eng. B: Rev. 18 (2012) 301–311.
- W. Ando, J.J. Kutcher, R. Krawetz, A. Sen, N. Nakamura, C.B. Frank, et al., Clonal analysis of synovial fluid stem cells to characterize and identify stable mesenchymal stromal cell/mesenchymal progenitor cell phenotypes in a porcine model: a cell source with enhanced commitment to the chondrogenic lineage, Cytotherapy 16 (2014) 776–788.
- K.B.L. Lee, J.H.P. Hui, I.C. Song, L. Ardany, E.H. Lee, Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model, Stem Cells 25 (2007) 2964–2971.
- W.-L. Fu, C.-Y. Zhou, J.-K. Yu, A new source of mesenchymal stem cells for articular cartilage repair: mSCs derived from mobilized peripheral blood share similar biological characteristics in vitro and chondrogenesis in vivo as MSCs from bone marrow in a rabbit model , Am. J. Sports Med. 42 (2014) 592–601.
- X. Xie, Y. Wang, C. Zhao, S. Guo, S. Liu, W. Jia, et al., Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration , Biomaterials 33 (2012) 7008–7018.
- E.-R. Chiang, H.-L. Ma, J.-P. Wang, C.-L. Liu, T.-H. Chen, S.-C. Hung, Allogeneic mesenchymal stem cells in combination with hyaluronic acid for the treatment of osteoarthritis in rabbits , PLoS One 11 (2016) e0149835.
- H. Nejadnik, J.H. Hui, E.P. Feng Choong, B.-C. Tai, E.H. Lee, Autologous bone marrow–derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study , Am. J. Sports Med. 38 (2010) 1110–1116.
- I. Sekiya, T. Muneta, M. Horie, H. Koga, Arthroscopic transplantation of synovial stem cells improves clinical outcomes in knees with cartilage defects , Clin. Orthop. Rel. Res. 473 (2015) 2316–2326.
- Y.S. Kim, Y.J. Choi, Y.G. Koh, Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors influencing clinical outcomes , Am. J. Sports Med. 43 (2015) 2293–2301.
- W.-L. Fu, Y.-F. Ao, X.-Y. Ke, Z.-Z. Zheng, X. Gong, D. Jiang, et al., Repair of large full-thickness cartilage defect by activating endogenous peripheral blood stem cells and autologous periosteum flap transplantation combined with patellofemoral realignment , Knee 21 (2014) 609–612.
- Y.-G. Koh, O.-R. Kwon, Y.-S. Kim, Y.-J. Choi, D.-H. Tak, Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial , Arthrosc. J. Arthrosc. Relat. Surg. 32 (2016) 97–109.
- T.S. de Windt, L.A. Vonk, I.C.M. Slaper-Cortenbach, M.P.H. van den Broek, R. Nizak, M.H.P. van Rijen, et al., Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-Stage cartilage repair in humans upon mixture with recycled autologous chondrons , Stem Cells (2016) (n/a-n/a).
- L. da Silva Meirelles, A.M. Fontes, D.T. Covas, A.I. Caplan, Mechanisms involved in the therapeutic properties of mesenchymal stem cells , Cytokine Growth Factor Rev. 20 (2009) 419–427.
- W.S. Toh, C.B. Foldager, M. Pei, J.H.P. Hui, Advances in mesenchymal stem cell-based strategies for cartilage repair and regeneration , Stem Cell Rev. Rep. 10 (2014) 686–696.
- R.C. Lai, F. Arslan, M.M. Lee, N.S.K. Sze, A. Choo, T.S. Chen, et al., Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury , Stem Cell Res. 4 (2010) 214–222.
- S. Zhang, W.C. Chu, R.C. Lai, S.K. Lim, J.H.P. Hui, W.S. Toh, Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration, Osteoarthr . Cartil. 24 (2016) 2135–2140.
- S. Zhang, W. Chu, R. Lai, J. Hui, E. Lee, S. Lim, et al., 21 – human mesenchymal stem cell-derived exosomes promote orderly cartilage regeneration in an immunocompetent rat osteochondral defect model , Cytotherapy 18 (2016) S13.
- C.T. Lim, X. Ren, M.H. Afizah, S. Tarigan-Panjaitan, Z. Yang, Y. Wu, et al., Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol) fumarate] hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model
- A. Gobbi, G. Karnatzikos, S.R. Sankineani, One-step surgery with multipotent stem cells for the treatment of large full-thickness chondral defects of the knee , Am. J. Sports Med. 42 (2014) 648–657.
- A. Gobbi, C. Scotti, G. Karnatzikos, A. Mudhigere, M. Castro, G.M. Peretti, One-step surgery with multipotent stem cells and Hyaluronan-based scaffold for the treatment of full-thickness chondral defects of the knee in patients older than 45 years , Knee Surg. Sports Traumatol. Arthrosc. (2016) 1–8.
- A. Gobbi, G. Karnatzikos, C. Scotti, V. Mahajan, L. Mazzucco, B. Grigolo, One-step cartilage repair with bone marrow aspirate concentrated cells and collagen matrix in full-thickness knee cartilage lesions: results at 2-Year follow-up , Cartilage 2 (2011) 286–299.
- K.L. Wong, K.B.L. Lee, B.C. Tai, P. Law, E.H. Lee, J.H.P. Hui, Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years’ follow-up , Arthrosc. J. Arthrosc. Relat. Surg. 29 (2013) 2020–2028.
- J.M. Hare, J.E. Fishman, G. Gerstenblith, et al., Comparison of allogeneic vs autologous bone marrow–derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy: the poseidon randomized trial, JAMA 308 (2012) 2369–2379.
- L. Wu, J.C.H. Leijten, N. Georgi, J.N. Post, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells increase chondrocyte proliferation and matrix formation , Tissue Eng. A 17 (2011) 1425–1436.
- L. Wu, H.-J. Prins, M.N. Helder, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells in chondrocyte Co-Cultures are independent of culture conditions and cell sources , Tissue Eng. A 18 (2012) 1542–1551.
- S.K. Sze, D.P.V. de Kleijn, R.C. Lai, E. Khia Way Tan, H. Zhao, K.S. Yeo, et al., Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells , Mol. Cell. Proteomics 6 (2007) 1680–1689.
- M.B. Murphy, K. Moncivais, A.I. Caplan, Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine , Exp. Mol. Med. 45 (2013) e54.
- M.J. Lee, J. Kim, M.Y. Kim, Y.-S. Bae, S.H. Ryu, T.G. Lee, et al., Proteomic analysis of tumor necrosis factor--induced secretome of human adipose tissue-derived mesenchymal stem cells , J. Proteome Res. 9 (2010) 1754–1762.
- S. Bruno, C. Grange, M.C. Deregibus, R.A. Calogero, S. Saviozzi, F. Collino, et al., Mesenchymal stem cell-derived microvesicles protect against acute tubular injury, J. Am. Soc. Nephrol. 20 (2009) 1053–1067.
- M. Yá˜nez-Mó, P.R.-M. Siljander, Z. Andreu, A.B. Zavec, F.E. Borràs, E.I. Buzas, et al. Biological properties of extracellular vesicles and their physiological functions (2015).
- C. Lawson, J.M. Vicencio, D.M. Yellon, S.M. Davidson, Microvesicles and exosomes: new players in metabolic and cardiovascular disease , J. Endocrinol. 228 (2016) R57–R71.
- A.G. Thompson, E. Gray, S.M. Heman-Ackah, I. Mager, K. Talbot, S.E. Andaloussi, et al., Extracellular vesicles in neurodegenerative diseas—pathogenesis to biomarkers, Nat. Rev. Neurol. 12 (2016) 346–357.
- I.E.M. Bank, L. Timmers, C.M. Gijsberts, Y.-N. Zhang, A. Mosterd, J.-W. Wang, et al., The diagnostic and prognostic potential of plasma extracellular vesicles for cardiovascular disease , Expert Rev. Mol. Diagn. 15 (2015) 1577–1588.
- T. Kato, S. Miyaki, H. Ishitobi, Y. Nakamura, T. Nakasa, M.K. Lotz, et al., Exosomes from IL-1 stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes , Arthritis. Res. Ther. 16 (2014) 1–11.
- R.W.Y. Yeo, S.K. Lim, Exosomes and their therapeutic applications, in: C. Gunther, A. Hauser, R. Huss (Eds.), Advances in Pharmaceutical Cell TherapyPrinciples of Cell-Based Biopharmaceuticals, World Scientific, Singapore, 2015, pp. 477–491.
- X. Qi, J. Zhang, H. Yuan, Z. Xu, Q. Li, X. Niu, et al., Exosomes secreted by human-Induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats , Int. J. Biol. Sci. 12 (2016) 836–849.
- R.C. Lai, F. Arslan, S.S. Tan, B. Tan, A. Choo, M.M. Lee, et al., Derivation and characterization of human fetal MSCs: an alternative cell source for large-scale production of cardioprotective microparticles , J. Mol. Cell. Cardiol. 48 (2010) 1215–1224.
- Y. Zhou, H. Xu, W. Xu, B. Wang, H. Wu, Y. Tao, et al., Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro , Stem Cell Res. Ther. 4 (2013) 1–13.
- Y. Qin, L. Wang, Z. Gao, G. Chen, C. Zhang, Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo , Sci. Rep. 6 (2016) 21961.
- M. Nakano, K. Nagaishi, N. Konari, Y. Saito, T. Chikenji, Y. Mizue, et al., Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes , Sci. Rep. 6 (2016) 24805.
- K. Nagaishi, Y. Mizue, T. Chikenji, M. Otani, M. Nakano, N. Konari, et al., Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes , Sci. Rep. 6 (2016) 34842.
- S.R. Baglio, K. Rooijers, D. Koppers-Lalic, F.J. Verweij, M. Pérez Lanzón, N. Zini, et al., Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species , Stem Cell Res. Ther. 6 (2015) 1–20.
- T. Chen, R. Yeo, F. Arslan, Y. Yin, S. Tan, Efficiency of exosome production correlates inversely with the developmental maturity of MSC donor, J. Stem Cell Res. Ther. 3 (2013) 2.
- R.C. Lai, S.S. Tan, B.J. Teh, S.K. Sze, F. Arslan, D.P. de Kleijn, et al., Proteolytic potential of the MSC exosome proteome: implications for an exosome-mediated delivery of therapeutic proteasome , Int. J. Proteomics 2012 (2012) 971907.
- T.S. Chen, R.C. Lai, M.M. Lee, A.B.H. Choo, C.N. Lee, S.K. Lim, Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs , Nucleic Acids Res. 38 (2010) 215–224.
- R.W. Yeo, R.C. Lai, K.H. Tan, S.K. Lim, Exosome: a novel and safer therapeutic refinement of mesenchymal stem cell, J. Circ. Biomark. 1 (2013) 7.
- R.C. Lai, R.W. Yeo, S.K. Lim, Mesenchymal stem cell exosomes, Semin. Cell Dev. Biol. 40 (2015) 82–88.
- B. Zhang, R.W. Yeo, K.H. Tan, S.K. Lim, Focus on extracellular vesicles: therapeutic potential of stem cell-derived extracellular vesicles , Int. J. Mol. Sci. 17 (2016) 174.
- Hu G-w, Q. Li, X. Niu, B. Hu, J. Liu, Zhou S-m, et al., Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice , Stem Cell Res. Ther. 6 (2015) 1–15.
- J. Zhang, J. Guan, X. Niu, G. Hu, S. Guo, Q. Li, et al., Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis , J. Transl. Med. 13 (2015) 1–14.
- B. Zhang, M. Wang, A. Gong, X. Zhang, X. Wu, Y. Zhu, et al., HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing, Stem Cells 33 (2015) 2158–2168.
- B. Zhang, Y. Yin, R.C. Lai, S.S. Tan, A.B.H. Choo, S.K. Lim, Mesenchymal stem cells secrete immunologically active exosomes , Stem Cells Dev. 23 (2013) 1233–1244.
- C.Y. Tan, R.C. Lai, W. Wong, Y.Y. Dan, S.-K. Lim, H.K. Ho, Mesenchymal stem cell-derived exosomes promote hepatic regeneration in drug-induced liver injury models , Stem Cell Res. Ther. 5 (2014) 1–14.
- C. Lee, S.A. Mitsialis, M. Aslam, S.H. Vitali, E. Vergadi, G. Konstantinou, et al., Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension , Circulation 126 (2012) 2601–2611.
- B. Yu, H. Shao, C. Su, Y. Jiang, X. Chen, L. Bai, et al., Exosomes derived from MSCs ameliorate retinal laser injury partially by inhibition of MCP-1 , Sci. Rep. 6 (2016) 34562.
- Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof of concept clinical trial. Stem Cells. 2014;32(5):1254–66.
- Vega, Aurelio, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681–90.
- Davatchi F, Sadeghi-Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis. Preliminary report of four patients. Int J Rheum Dis. 2011;14(2):211–5
- Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case- controlled study. Int Orthop. 2014;38(9):1811–1818
- Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives. Biomed Res Int. 2014;2014:6.
- Beitzel K, Solovyova O, Cote MP, et al. The future role of mesenchymal Stem cells in The management of shoulder disorders . Arthroscopy. 2013;29(10):1702–1711.
- Isaac C, Gharaibeh B, Witt M, Wright VJ, Huard J. Biologic approaches to enhance rotator cuff healing after injury. J Shoulder Elbow Surg. 2012;21(2):181–190.
- Malda, Jos, et al. " Extracellular vesicles [mdash] new tool for joint repair and regeneration. " Nature Reviews Rheumatology (2016).
Weiterführende Literatur zu PRP
- Rubio-Azpeitia E, Andia I. Partnership between platelet-rich plasma and mesenchymal stem cells: in vitro experience. Muscles Ligaments Tendons J. 2014;4(1):52–62.
Extras
- Xu, Ming, et al. " Transplanted senescent cells induce an osteoarthritis-like condition in mice. " The Journals of Gerontology Series A: Biological Sciences and Medical Sciences (2016): glw154.
- McCulloch, Kendal, Gary J. Litherland, and Taranjit Singh Rai. " Cellular senescence in osteoarthritis pathology ." Aging Cell (2017).
Patienten-Services des ANOVA Institute for Regenerative Medicine
- Das Institut liegt in Offenbach am Main, im Herzen Deutschlands, weniger als 20 Minuten vom Frankfurter Flughafen entfernt
- Individualisierte Therapie mit innovativen Stammzellprodukten
- Individuell geplante diagnostische Untersuchungen mit modernen MR- und CT-Geräten und Blutuntersuchungen
- Deutscher Qualitätsstandard (100% made in Germany) für Produktsicherheit und Qualitätssicherung
- Persönlicher Service mit freundlichen, engagierten Patientenbetreuern und Krankenschwestern
- Stetiger wissenschaftlicher Austausch mit akademischen Einrichtungen, um Ihnen die innovativsten Behandlungen im Bereich regenerative Medizin anbieten zu können