Anti-Ageing-TherapieAnti-Aging-Therapie
Stammzelltherapie, Entfernung seneszenter Zellen und Phytotherapie
bei ANOVA IRM in Offenbach, Deutschland
Niemand von uns kann in der Zeit zurückreisen. Worum geht es also bei Anti-Aging und Verjüngung? Um diese Frage zu beantworten, müssen wir die Prozesse hinter dem Altern verstehen. Mit zunehmendem Alter lassen die normalen Funktionen unseres Körpers im Vergleich zu jungen Jahren nach. Gleichzeitig treten mit dem Älterwerden auch Krankheiten häufiger auf. Sowohl Funktionsdefizite als auch Krankheiten manifestieren sich auf makroskopischer Ebene und betreffen Gewebe und Organe wie Haut und Herz. Sie haben jedoch ihren Ursprung in Veränderungen auf zellulärer und molekularer Ebene, die zu genetischen, metabolischen, entzündlichen, immunologischen und neoplastischen Pathologien führen. Mit den Fortschritten der Wissenschaft werden neue Anti-Aging-Strategien entwickelt.
Altern - Wissenschaft - Therapien - Medikamente - Stammzellbehandlungen – Diagnostik
Da das Altern ein komplexer Prozess ist, erfordert eine effektive Anti-Aging- und Verjüngungskur einen umfassenden Ansatz. Auf dieser Seite fassen wir die umfassenden Anti-Aging- und Verjüngungsbehandlungen zusammen, die wir am ANOVA Institut für Regenerative Medizin in Offenbach (bei Frankfurt/Main) entwickelt haben, und wie wir Ihnen helfen können, jünger zu bleiben und ein aktiveres und gesünderes Leben zu führen.
Eine umfassende Anti-Aging-Strategie sollte Folgendes beinhalten:
- Krankheitsvorbeugung und Früherkennung
- Aerobic, Widerstandstraining (Krafttraining) sowie Dehnung, Flexibilität und Balance
- Optimierung des Stoffwechsels: Ernährung, Nahrungsergänzungsmittel, Infusionen, verschreibungspflichtige Medikamente
- Hormonelle Optimierung/Substitution
- Entfernung seneszenter Zellen
- Stammzell- und Stammzellsekretom-Therapien
- Topische Anwendung von systemischen Medikamenten (Haut und Haare)
Springen Sie direkt zu den folgenden Themen:
- ANOVA Anti-Aging-Programm
- Krankheitsvorbeugung und Früherkennung
- Unsere Exosomen-Behandlung
- Verschreibungspflichtige Medikamente für Anti-Aging
- Ernährung
- Ablauf des Behandlungsprozesses
- Diagnostik von schmerzverursachenden Defekten
- Der ANOVA-Unterschied: gezielte Behandlung
- Sie wollen eine zweite Meinung
- Quellen und Literatur
Flyer Anti Aging
Umfassendes Anti-Aging-Programm am
ANOVA Institut für Regenerative Medizin - Offenbach, Deutschland
Diagnostik, Medikamente, Infusionstherapie, BMC-Stammzellen, Sekretome/Exosomen, PRP
Krankheitsvorbeugung und Früherkennung
Anti-Aging beginnt mit Krankheitsvorbeugung und Früherkennung. Die moderne Medizin bietet wirksame Möglichkeiten, Krankheiten in einem frühen, heilbaren Stadium zu erkennen. Diese reichen von der genetischen und molekularen Diagnostik bis zur hochauflösenden Bildgebung des gesamten Körpers. Der beste Weg, die negativen Auswirkungen von Krankheiten zu vermeiden, ist die Vorbeugung von Krankheiten. Die frühzeitige Erkennung von Krankheiten verbessert die Chancen, sie zu heilen oder zumindest ihr Fortschreiten zu verlangsamen. Heutzutage ist dazu eine breite Palette an Tests möglich:
- Labortests für Stoffwechsel, Hormone, Tumormarker, Vitamine und Mineralien
- Gentests, die ein erhöhtes Risiko für bestimmte Krankheiten aufzeigen
- Funktionstests von Herz, Gefäßen, Lunge, Nieren usw.
- Bildgebende Untersuchungen wie Ganzkörper-MRT, Koronar-CT, Niedrigdosis-CT der Lunge (für Raucher), Herz-Kreislauf-Sonographie, virtuelle Koloskopie, Osteodensitometrie usw.
Ganzkörper-Bildgebung
Mit der Ganzkörper-MRT lassen sich Tumore, degenerative Veränderungen der Gelenke und der Wirbelsäule, atherosklerotische Gefäßverengungen und die daraus resultierende Mangeldurchblutung von Herz, Gehirn oder Nieren, frühe neurodegenerative Veränderungen des Gehirns, Probleme der Leber, der Bauchspeicheldrüse und des Magen-Darm-Trakts - um nur einige zu nennen - erkennen. Am ANOVA Institute of Regenerative Medicine setzen wir moderne bildgebende Verfahren ein, um selbst kleinste Veränderungen im Körper unserer Patienten aufzudecken und so das Fortschreiten von Alter und Krankheit aufzuhalten:
- Calcium-Scoring: Der wichtigste Prädiktor für Herzinfarkte
- Virtuelle Koloskopie: Dickdarmkrebs-Screening ohne Endoskopie
- Lungenscreening mit niedriger Strahlendosis: Frühzeitige Erkennung von Lungenkrebs bei Rauchern
- MR-Mammographie: Das einzige wirksame Brustkrebs-Screening-Verfahren
- MR-Angiographie: Beurteilung von Gefäßen und Blutversorgung im gesamten Körper
- Prostata-MRT: Früherkennung von Prostatakrebs bei Männern
- Kardio-MRT: Umfassende Beurteilung des Herzens
- CT-Osteo-Densitometrie: Präzise Beurteilung der Knochenmineralisierung
Unsere Fachärzte beraten Sie, welche Tests für Sie und Ihre spezifischen Gesundheitsfragen am besten geeignet sind.
Verschreibungspflichtige Medikamente zur Verhinderung von Alterserscheinungen
Bestimmte verschreibungspflichtige Arzneimittel haben sich als wirksame Therapeutika zur Behandlung von Krankheiten erwiesen, die mit dem Altern einhergehen. Viele Patienten weisen Anzeichen von Prädiabetes oder chronischen Entzündungen auf, die zur Alterung beitragen. Einige Behandlungen haben Nebenwirkungen wie die allgemeine Optimierung des Stoffwechsels oder die Beseitigung seneszenter (alternden) Zellen, die sich synergistisch positiv auswirken.
Wir beraten Sie zu : verschreibungspflichtigen Medikamenten wie:
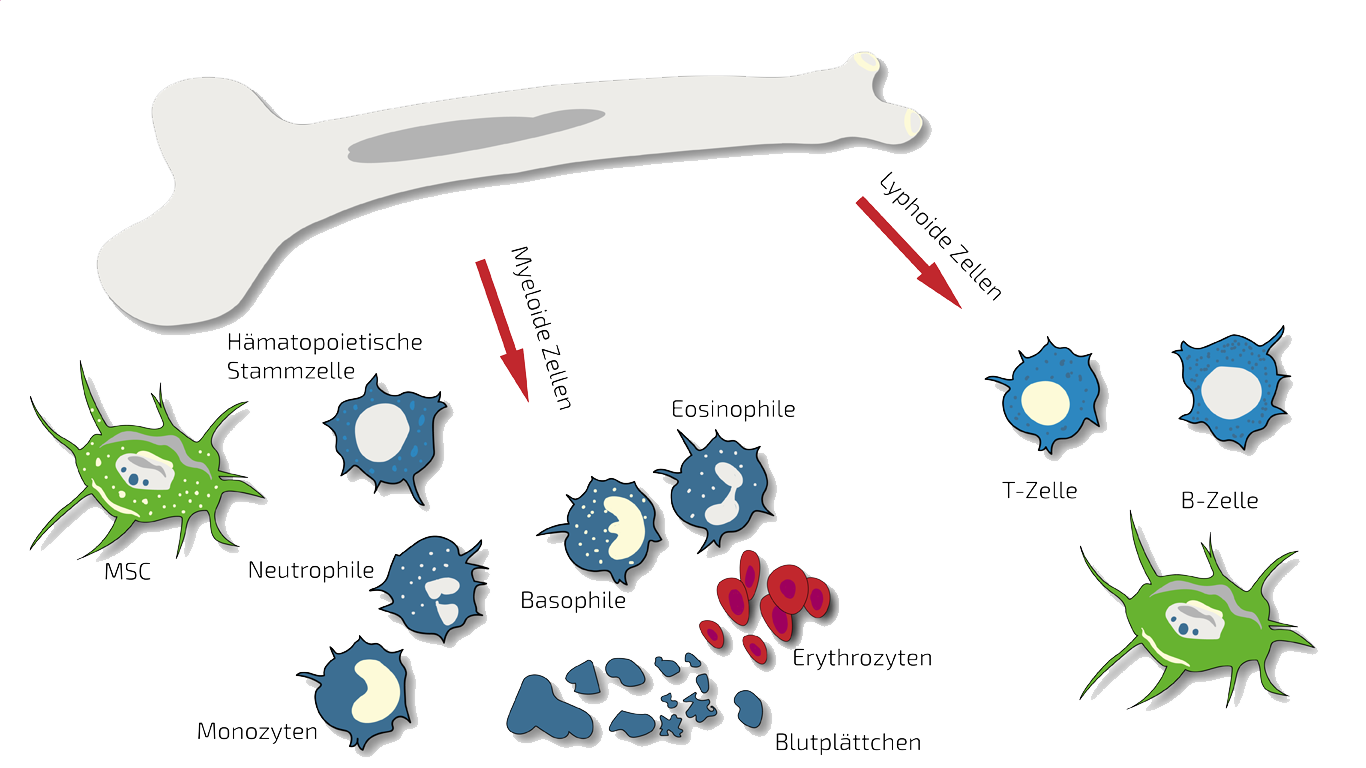
MSEC - Mesenchymale Stammzellsekretome - Exosomen - Autolog (körpereigen)
Da Altern ein kontinuierlicher Prozess ist, behandeln wir die meisten Anti-Aging-Patienten mit MSEC (Sekretome, Exosomen, EVs) aus mesenchymalen Stammzellen (MSC, AD-MSC, Fettstammzellen), die wir in einer Mini-Liposuktion (sehr kurze und begrenzte Fettabsaugung) unter leichter Sedierung aus dem Bauch des Patienten gewinnen. ANOVA ist weltweit die erste Stammzellklinik, die eine gesetzliche Erlaubnis von den zuständigen Regierungsbehörden erhalten hat und daher qualitativ hochwertige, sichere und gesetzlich kontrollierte autologe (eigene) exosomhaltige Sekrete anbietet.
Der Hauptvorteil von MSEC ist, dass sie im Gegensatz zu lebenden Stammzellen ohne Verlust der Exosomen eingefroren werden können. Dies ermöglicht es uns, 10-20 Injektionsdosen aus einer Fettabsaugung herzustellen, die dann über einen längeren Behandlungszeitraum verabreicht werden können. Dies ist besonders vorteilhaft für eine langfristige Anti-Aging-Behandlung. Was ein Sekretom/Exosom ist und wie sie sich vergleichen, erfahren Sie auf unserer Übersichtsseite. Lesen Sie weiter unten mehr über Stammzellen und Anti-Aging..
BMC - Knochenmarkskonzentrat - autolog (körpereigen)
Autologes (eigenes) BMC ist unsere wichtigste Therapieoption bei lokal begrenzten entzündlichen Erkrankungen, da es sich um eine "One-donation-one"-Behandlungsoption handelt.
In solchen Fällen behandeln wir speziell einzelne Regionen oder Gelenke mit gezielten, lokalisierten BMC-Injektionen. BMC enthält autologe, also patienteneigene, adulte Stammzellen (hämatopoetische und mesenchymale Stammzellen in natürlicher Zusammensetzung), die wir in einem kurzen Verfahren unter leichter Sedierung aus Ihrem Beckenkamm isolieren und konzentrieren.
Diese Stammzellen sollen die Entzündung hemmen, Sie dadurch von Schmerzen befreien und die Regeneration des Gelenkknorpels oder Knochens anregen. Für eine fortlaufende Therapie kombinieren wir BMC mit PRP (platelet-rich plasma) PRP (plättchenreiches Plasma) oder Hyaluronsäure (HA, siehe unten). Weitere Informationen über diese Art der Stammzelltherapie finden Sie auf unserer Seite über BMC.
PRP - Plättchenreiches Plasma - körpereigen
PRP ist eine vergleichsweise kostengünstige experimentelle Therapie, da Thrombozyten ( die von Natur aus Wachstumsfaktoren und Stimulanzien enthalten) aus autologem (eigenem) Blut isoliert werden, ohne dass Stammzellen isoliert werden müssen. In der Anti-Aging-Behandlung setzen wir PRP häufig in Kombination mit BMC ein und verabreichen es zwischen den BMC-Behandlungen, um die entzündungshemmenden Effekte kontinuierlich zu unterstützen. Daneben ist PRP auch als Wundheilungsstimulans für die Haut oder als Maßnahme gegen Haarausfall bekannt. Mehr zu PRP (als Kombinationstherapie) ist auf unserer PRP-Übersichtsseite zusammengefasst..
Hyaluronsäure - HA
Eine weitere, kostengünstige unterstützende Behandlung ist die Injektion von Hyaluronsäure in die betroffenen Gelenke.
Besonders in frühen Fällen kann dies die Schmerzen lindern und zu einer besseren "Schmierung" der Gelenke führen. Die Knochenteile knirschen nach der HA-Injektion nicht direkt aufeinander.
Von Hyaluronsäure allein ist hingegen keine regenerative Wirkung auf den geschädigten Knorpel oder Knochen zu erwarten.
Daher kombinieren wir HA in der Regel mit einer BMC-Behandlung
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben Sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
Referenzen
- Kyong-Oh Shin, Dae Hyun Ha, Jin Ock Kim, Debra A Crumrine, Jason M Meyer, Joan S Wakefield, Yerin Lee, Bogyeong Kim, Sungeun Kim, Hyun-Keun Kim, Joon Lee, Hyuck Hoon Kwon, Gyeong-Hun Park, Jun Ho Lee, Jihye Lim, Sejeong Park, Peter M Elias, Kyungho Park, Yong Weon Yi, Byong Seung Cho "Exosomes from Human Adipose Tissue-Derived Mesenchymal Stem Cells Promote Epidermal Barrier Repair by Inducing de Novo Synthesis of Ceramides in Atopic Dermatitis". Cells. 2020 Mar 10;9(3):680.
- Congxiu Ye, Yunqing Zhang, Zhen Su, Shuxia Wu, Yuxia Li, Jinling Yi, Wei Lai, Jian Chen, Yue Zheng "hMSC exosomes as a novel treatment for female sensitive skin: An in vivo study". Front Bioeng Biotechnol. 2022 Oct 21;10:1053679.
- Xin Wang, Qiuhong Wang, Panpan Yin, Chen Liang, Xiaohui Zhao, Dingke Wen, Yi Tan "Secretome of human umbilical cord mesenchymal stem cell maintains skin homeostasis by regulating multiple skin physiological function". Cell Tissue Res. 2023 Jan;391(1):111-125.
- Hao Xiong, Jin Yang, Tao Liu, Guangren Liu, Yongzhi Han, Xiuqin Dong "Stem Cells from Human Exfoliated Deciduous Teeth Attenuate Atopic Dermatitis Symptoms in Mice through Modulating Immune Balance and Skin Barrier Function". Mediators Inflamm. 2022 Jul 21;2022:6206883.
- Sung Youl Kim, Tae Hong Yoon, Jungtae Na, Seong Joon Yi, Yunseok Jin, Minji Kim, Tae-Ho Oh, Tae-Wook Chung "Mesenchymal Stem Cells and Extracellular Vesicles Derived from Canine Adipose Tissue Ameliorates Inflammation, Skin Barrier Function and Pruritus by Reducing JAK/STAT Signaling in Atopic Dermatitis". Int J Mol Sci. 2022 Apr 27;23(9):4868.
- Barbara Bellei, Emilia Migliano, Mauro Picardo "Therapeutic potential of adipose tissue-derivatives in modern dermatology". Exp Dermatol. 2022 Dec;31(12):1837-1852.
- Hongli Zhao, Lijun Hao, Xinyao Chen, Ruoxue Bai, Sai Luo "An Efficacy Study of a New Radical Treatment for Acne Vulgaris Using Fat Injection". Aesthet Surg J. 2021 Jul 14;41(8):NP1061-NP1072.
- Xiaoxi Li, Sai Luo, Xinyao Chen, Shasha Li, Lijun Hao, Dan Yang "Adipose-derived stem cells attenuate acne-related inflammation via suppression of NLRP3 inflammasome". Stem Cell Res Ther. 2022 Jul 23;13(1):334.
Weiterführende Literatur zu MSC, BMC, Stamzellen Secretom und EVs
- Georg Hansmann, Philippe Chouvarine, Franziska Diekmann, Martin Giera, Markus Ralser, Michael Mülleder, Constantin von Kaisenberg, Harald Bertram, Ekaterina Legchenko & Ralf Hass "Human umbilical cord mesenchymal stem cell-derived treatment of severe pulmonary arterial hypertension". Nature Cardiovascular Research volume 1, pages568–576 (2022).
- Murphy JM, Fink DJ, Hunziker EB, et al. Stem cell therapy in a caprine model of osteoarthritis . Arthritis Rheum. 2003;48:3464–74.
- Lee KB, Hui JH, Song IC, Ardany L, et al. Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model. Stem Cell. 2007;25:2964–71.
- Saw KY, Hussin P, Loke SC, et al. Articular cartilage regeneration with autologous marrow aspirate and hyaluronic acid: an experimental study in a goat model. Arthroscopy . 2009;25(12):1391–400.
- Black L, Gaynor J, Adams C, et al. Effect of intra-articular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Vet Ther. 2008;9:192-200.
- Centeno C, Busse D, Kisiday J, et al. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells. Pain Physician. 2008;11(3):343–53.
- Centeno C, Kisiday J, Freeman M, et al. Partial regeneration of the human hip via autologous bone marrow nucleated cell transfer: a case study. Pain Physician. 2006;9:253–6.
- Centeno C, Schultz J, Cheever M. Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique. Curr Stem Cell. 2011;5(1):81–93.
- Pak J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose derived stem cells: a case series. J Med Case Rep. 2001;5:296.
- Kuroda R, Ishida K, et al. Treatment of a full-thickness articular cartilage defect in the femoral condyle of an athlete with autologous bone-marrow stromal cells. Osteoarthritis Cartilage. 2007;15:226–31.
- Emadedin M, Aghdami N, Taghiyar L, et al. Intra-articular injection of autologous mesenchymal stem cells in six patients with knee osteoarthritis. Arch Iran Med. 2012;15(7):422–8.
- Saw KY et al. Articular cartilage regeneration with autologous peripheral blood stem cells versus hyaluronic acid: a randomized controlled trial. Arthroscopy. 2013;29(4):684–94.
- Vangsness CT, Farr J, Boyd J, et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy. J Bone Joint Surg. 2014;96(2):90–8.
- Freitag, Julien, et al. Mesenchymal stem cell therapy in the treatment of osteoarthritis: reparative pathways, safety and efficacy–a review. BMC musculoskeletal disorders 17.1 (2016): 230.
- Maumus, Marie, Christian Jorgensen, and Danièle Noël. " Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. " Biochimie 95.12 (2013): 2229-2234.
- Dostert, Gabriel, et al. " How do mesenchymal stem cells influence or are influenced by microenvironment through extracellular vesicles communication?. " Frontiers in Cell and Developmental Biology 5 (2017).
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- Toh, Wei Seong, et al. " MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. " Seminars in Cell & Developmental Biology. Academic Press, 2016.
- Chaparro, Orlando, and Itali Linero. " Regenerative Medicine: A New Paradigm in Bone Regeneration. " (2016).
- S. Koelling, J. Kruegel, M. Irmer, J.R. Path, B. Sadowski, X. Miro, et al., Migratory chondrogenic progenitor cells from repair tissue during the later stages of human osteoarthritis , Cell Stem Cell 4 (2009) 324–335.
- B.A. Jones, M. Pei, Synovium-Derived stem cells: a tissue-Specific stem cell for cartilage engineering and regeneration , Tissue Eng. B: Rev. 18 (2012) 301–311.
- W. Ando, J.J. Kutcher, R. Krawetz, A. Sen, N. Nakamura, C.B. Frank, et al., Clonal analysis of synovial fluid stem cells to characterize and identify stable mesenchymal stromal cell/mesenchymal progenitor cell phenotypes in a porcine model: a cell source with enhanced commitment to the chondrogenic lineage, Cytotherapy 16 (2014) 776–788.
- K.B.L. Lee, J.H.P. Hui, I.C. Song, L. Ardany, E.H. Lee, Injectable mesenchymal stem cell therapy for large cartilage defects—a porcine model, Stem Cells 25 (2007) 2964–2971.
- W.-L. Fu, C.-Y. Zhou, J.-K. Yu, A new source of mesenchymal stem cells for articular cartilage repair: mSCs derived from mobilized peripheral blood share similar biological characteristics in vitro and chondrogenesis in vivo as MSCs from bone marrow in a rabbit model , Am. J. Sports Med. 42 (2014) 592–601.
- X. Xie, Y. Wang, C. Zhao, S. Guo, S. Liu, W. Jia, et al., Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration , Biomaterials 33 (2012) 7008–7018.
- E.-R. Chiang, H.-L. Ma, J.-P. Wang, C.-L. Liu, T.-H. Chen, S.-C. Hung, Allogeneic mesenchymal stem cells in combination with hyaluronic acid for the treatment of osteoarthritis in rabbits , PLoS One 11 (2016) e0149835.
- H. Nejadnik, J.H. Hui, E.P. Feng Choong, B.-C. Tai, E.H. Lee, Autologous bone marrow–derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study , Am. J. Sports Med. 38 (2010) 1110–1116.
- I. Sekiya, T. Muneta, M. Horie, H. Koga, Arthroscopic transplantation of synovial stem cells improves clinical outcomes in knees with cartilage defects , Clin. Orthop. Rel. Res. 473 (2015) 2316–2326.
- Y.S. Kim, Y.J. Choi, Y.G. Koh, Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors influencing clinical outcomes , Am. J. Sports Med. 43 (2015) 2293–2301.
- W.-L. Fu, Y.-F. Ao, X.-Y. Ke, Z.-Z. Zheng, X. Gong, D. Jiang, et al., Repair of large full-thickness cartilage defect by activating endogenous peripheral blood stem cells and autologous periosteum flap transplantation combined with patellofemoral realignment , Knee 21 (2014) 609–612.
- Y.-G. Koh, O.-R. Kwon, Y.-S. Kim, Y.-J. Choi, D.-H. Tak, Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial , Arthrosc. J. Arthrosc. Relat. Surg. 32 (2016) 97–109.
- T.S. de Windt, L.A. Vonk, I.C.M. Slaper-Cortenbach, M.P.H. van den Broek, R. Nizak, M.H.P. van Rijen, et al., Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-Stage cartilage repair in humans upon mixture with recycled autologous chondrons , Stem Cells (2016) (n/a-n/a).
- L. da Silva Meirelles, A.M. Fontes, D.T. Covas, A.I. Caplan, Mechanisms involved in the therapeutic properties of mesenchymal stem cells , Cytokine Growth Factor Rev. 20 (2009) 419–427.
- W.S. Toh, C.B. Foldager, M. Pei, J.H.P. Hui, Advances in mesenchymal stem cell-based strategies for cartilage repair and regeneration , Stem Cell Rev. Rep. 10 (2014) 686–696.
- R.C. Lai, F. Arslan, M.M. Lee, N.S.K. Sze, A. Choo, T.S. Chen, et al., Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury , Stem Cell Res. 4 (2010) 214–222.
- S. Zhang, W.C. Chu, R.C. Lai, S.K. Lim, J.H.P. Hui, W.S. Toh, Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration, Osteoarthr . Cartil. 24 (2016) 2135–2140.
- S. Zhang, W. Chu, R. Lai, J. Hui, E. Lee, S. Lim, et al., 21 – human mesenchymal stem cell-derived exosomes promote orderly cartilage regeneration in an immunocompetent rat osteochondral defect model , Cytotherapy 18 (2016) S13.
- C.T. Lim, X. Ren, M.H. Afizah, S. Tarigan-Panjaitan, Z. Yang, Y. Wu, et al., Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol) fumarate] hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model
- A. Gobbi, G. Karnatzikos, S.R. Sankineani, One-step surgery with multipotent stem cells for the treatment of large full-thickness chondral defects of the knee , Am. J. Sports Med. 42 (2014) 648–657.
- A. Gobbi, C. Scotti, G. Karnatzikos, A. Mudhigere, M. Castro, G.M. Peretti, One-step surgery with multipotent stem cells and Hyaluronan-based scaffold for the treatment of full-thickness chondral defects of the knee in patients older than 45 years , Knee Surg. Sports Traumatol. Arthrosc. (2016) 1–8.
- A. Gobbi, G. Karnatzikos, C. Scotti, V. Mahajan, L. Mazzucco, B. Grigolo, One-step cartilage repair with bone marrow aspirate concentrated cells and collagen matrix in full-thickness knee cartilage lesions: results at 2-Year follow-up , Cartilage 2 (2011) 286–299.
- K.L. Wong, K.B.L. Lee, B.C. Tai, P. Law, E.H. Lee, J.H.P. Hui, Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years’ follow-up , Arthrosc. J. Arthrosc. Relat. Surg. 29 (2013) 2020–2028.
- J.M. Hare, J.E. Fishman, G. Gerstenblith, et al., Comparison of allogeneic vs autologous bone marrow–derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy: the poseidon randomized trial, JAMA 308 (2012) 2369–2379.
- L. Wu, J.C.H. Leijten, N. Georgi, J.N. Post, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells increase chondrocyte proliferation and matrix formation , Tissue Eng. A 17 (2011) 1425–1436.
- L. Wu, H.-J. Prins, M.N. Helder, C.A. van Blitterswijk, M. Karperien, Trophic effects of mesenchymal stem cells in chondrocyte Co-Cultures are independent of culture conditions and cell sources , Tissue Eng. A 18 (2012) 1542–1551.
- S.K. Sze, D.P.V. de Kleijn, R.C. Lai, E. Khia Way Tan, H. Zhao, K.S. Yeo, et al., Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells , Mol. Cell. Proteomics 6 (2007) 1680–1689.
- M.B. Murphy, K. Moncivais, A.I. Caplan, Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine , Exp. Mol. Med. 45 (2013) e54.
- M.J. Lee, J. Kim, M.Y. Kim, Y.-S. Bae, S.H. Ryu, T.G. Lee, et al., Proteomic analysis of tumor necrosis factor--induced secretome of human adipose tissue-derived mesenchymal stem cells , J. Proteome Res. 9 (2010) 1754–1762.
- S. Bruno, C. Grange, M.C. Deregibus, R.A. Calogero, S. Saviozzi, F. Collino, et al., Mesenchymal stem cell-derived microvesicles protect against acute tubular injury, J. Am. Soc. Nephrol. 20 (2009) 1053–1067.
- M. Yá˜nez-Mó, P.R.-M. Siljander, Z. Andreu, A.B. Zavec, F.E. Borràs, E.I. Buzas, et al. Biological properties of extracellular vesicles and their physiological functions (2015).
- C. Lawson, J.M. Vicencio, D.M. Yellon, S.M. Davidson, Microvesicles and exosomes: new players in metabolic and cardiovascular disease , J. Endocrinol. 228 (2016) R57–R71.
- A.G. Thompson, E. Gray, S.M. Heman-Ackah, I. Mager, K. Talbot, S.E. Andaloussi, et al., Extracellular vesicles in neurodegenerative diseas—pathogenesis to biomarkers, Nat. Rev. Neurol. 12 (2016) 346–357.
- I.E.M. Bank, L. Timmers, C.M. Gijsberts, Y.-N. Zhang, A. Mosterd, J.-W. Wang, et al., The diagnostic and prognostic potential of plasma extracellular vesicles for cardiovascular disease , Expert Rev. Mol. Diagn. 15 (2015) 1577–1588.
- T. Kato, S. Miyaki, H. Ishitobi, Y. Nakamura, T. Nakasa, M.K. Lotz, et al., Exosomes from IL-1 stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes , Arthritis. Res. Ther. 16 (2014) 1–11.
- R.W.Y. Yeo, S.K. Lim, Exosomes and their therapeutic applications, in: C. Gunther, A. Hauser, R. Huss (Eds.), Advances in Pharmaceutical Cell TherapyPrinciples of Cell-Based Biopharmaceuticals, World Scientific, Singapore, 2015, pp. 477–491.
- X. Qi, J. Zhang, H. Yuan, Z. Xu, Q. Li, X. Niu, et al., Exosomes secreted by human-Induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats , Int. J. Biol. Sci. 12 (2016) 836–849.
- R.C. Lai, F. Arslan, S.S. Tan, B. Tan, A. Choo, M.M. Lee, et al., Derivation and characterization of human fetal MSCs: an alternative cell source for large-scale production of cardioprotective microparticles , J. Mol. Cell. Cardiol. 48 (2010) 1215–1224.
- Y. Zhou, H. Xu, W. Xu, B. Wang, H. Wu, Y. Tao, et al., Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro , Stem Cell Res. Ther. 4 (2013) 1–13.
- Y. Qin, L. Wang, Z. Gao, G. Chen, C. Zhang, Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo , Sci. Rep. 6 (2016) 21961.
- M. Nakano, K. Nagaishi, N. Konari, Y. Saito, T. Chikenji, Y. Mizue, et al., Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes , Sci. Rep. 6 (2016) 24805.
- K. Nagaishi, Y. Mizue, T. Chikenji, M. Otani, M. Nakano, N. Konari, et al., Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes , Sci. Rep. 6 (2016) 34842.
- S.R. Baglio, K. Rooijers, D. Koppers-Lalic, F.J. Verweij, M. Pérez Lanzón, N. Zini, et al., Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species , Stem Cell Res. Ther. 6 (2015) 1–20.
- T. Chen, R. Yeo, F. Arslan, Y. Yin, S. Tan, Efficiency of exosome production correlates inversely with the developmental maturity of MSC donor, J. Stem Cell Res. Ther. 3 (2013) 2.
- R.C. Lai, S.S. Tan, B.J. Teh, S.K. Sze, F. Arslan, D.P. de Kleijn, et al., Proteolytic potential of the MSC exosome proteome: implications for an exosome-mediated delivery of therapeutic proteasome , Int. J. Proteomics 2012 (2012) 971907.
- T.S. Chen, R.C. Lai, M.M. Lee, A.B.H. Choo, C.N. Lee, S.K. Lim, Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs , Nucleic Acids Res. 38 (2010) 215–224.
- R.W. Yeo, R.C. Lai, K.H. Tan, S.K. Lim, Exosome: a novel and safer therapeutic refinement of mesenchymal stem cell, J. Circ. Biomark. 1 (2013) 7.
- R.C. Lai, R.W. Yeo, S.K. Lim, Mesenchymal stem cell exosomes, Semin. Cell Dev. Biol. 40 (2015) 82–88.
- B. Zhang, R.W. Yeo, K.H. Tan, S.K. Lim, Focus on extracellular vesicles: therapeutic potential of stem cell-derived extracellular vesicles , Int. J. Mol. Sci. 17 (2016) 174.
- Hu G-w, Q. Li, X. Niu, B. Hu, J. Liu, Zhou S-m, et al., Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells attenuate limb ischemia by promoting angiogenesis in mice , Stem Cell Res. Ther. 6 (2015) 1–15.
- J. Zhang, J. Guan, X. Niu, G. Hu, S. Guo, Q. Li, et al., Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis , J. Transl. Med. 13 (2015) 1–14.
- B. Zhang, M. Wang, A. Gong, X. Zhang, X. Wu, Y. Zhu, et al., HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing, Stem Cells 33 (2015) 2158–2168.
- B. Zhang, Y. Yin, R.C. Lai, S.S. Tan, A.B.H. Choo, S.K. Lim, Mesenchymal stem cells secrete immunologically active exosomes , Stem Cells Dev. 23 (2013) 1233–1244.
- C.Y. Tan, R.C. Lai, W. Wong, Y.Y. Dan, S.-K. Lim, H.K. Ho, Mesenchymal stem cell-derived exosomes promote hepatic regeneration in drug-induced liver injury models , Stem Cell Res. Ther. 5 (2014) 1–14.
- C. Lee, S.A. Mitsialis, M. Aslam, S.H. Vitali, E. Vergadi, G. Konstantinou, et al., Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension , Circulation 126 (2012) 2601–2611.
- B. Yu, H. Shao, C. Su, Y. Jiang, X. Chen, L. Bai, et al., Exosomes derived from MSCs ameliorate retinal laser injury partially by inhibition of MCP-1 , Sci. Rep. 6 (2016) 34562.
- Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof of concept clinical trial. Stem Cells. 2014;32(5):1254–66.
- Vega, Aurelio, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681–90.
- Davatchi F, Sadeghi-Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis. Preliminary report of four patients. Int J Rheum Dis. 2011;14(2):211–5
- Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case- controlled study. Int Orthop. 2014;38(9):1811–1818
- Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives. Biomed Res Int. 2014;2014:6.
- Beitzel K, Solovyova O, Cote MP, et al. The future role of mesenchymal Stem cells in The management of shoulder disorders . Arthroscopy. 2013;29(10):1702–1711.
- Isaac C, Gharaibeh B, Witt M, Wright VJ, Huard J. Biologic approaches to enhance rotator cuff healing after injury. J Shoulder Elbow Surg. 2012;21(2):181–190.
- Malda, Jos, et al. " Extracellular vesicles [mdash] new tool for joint repair and regeneration. " Nature Reviews Rheumatology (2016).
Weiterführende Literatur zu PRP
- Rubio-Azpeitia E, Andia I. Partnership between platelet-rich plasma and mesenchymal stem cells: in vitro experience. Muscles Ligaments Tendons J. 2014;4(1):52–62.
Extras
- Xu, Ming, et al. " Transplanted senescent cells induce an osteoarthritis-like condition in mice. " The Journals of Gerontology Series A: Biological Sciences and Medical Sciences (2016): glw154.
- McCulloch, Kendal, Gary J. Litherland, and Taranjit Singh Rai. " Cellular senescence in osteoarthritis pathology ." Aging Cell (2017).
Patienten-Services des ANOVA Institute for Regenerative Medicine
- Das Institut liegt in Offenbach am Main, im Herzen Deutschlands, weniger als 20 Minuten vom Frankfurter Flughafen entfernt
- Individualisierte Therapie mit innovativen Stammzellprodukten
- Individuell geplante diagnostische Untersuchungen mit modernen MR- und CT-Geräten und Blutuntersuchungen
- Deutscher Qualitätsstandard (100% made in Germany) für Produktsicherheit und Qualitätssicherung
- Persönlicher Service mit freundlichen, engagierten Patientenbetreuern und Krankenschwestern
- Stetiger wissenschaftlicher Austausch mit akademischen Einrichtungen, um Ihnen die innovativsten Behandlungen im Bereich regenerative Medizin anbieten zu können