ANOVA Stammzelltherapie für Knie-Verletzungen und -Degeneration
Sowohl Knieverletzungen als auch degenerative Veränderungen im Knie sind oft schmerzhaft und langwierig. Da das Knie ein sehr komplexes und vielfach beanspruchtes Gelenk ist, kommen Verletzungen häufig vor, aber es gibt bisher oft nur sehr begrenzt wirksame Therapieoptionen. Knie-Arthrose oder Knie-Arthritis werden meist zuerst medikamentös und dann mittels eines Gelenkersatzes behandelt. Wenn z.B. Knieschmerzen und ein unangenehmes Spannungsgefühl in der Kniekehle Ihre Symptome sind, kann es sich um die sogenannte Bakerzyste (oder Baker-Zyste) handeln. Eine weitere, häufige Knieverletzung ist der Meniskusriss oder Risse im vorderen oder hinteren Kreuzband. Solche und weitere Fälle erfordern eine effektive und schnelle Behandlung. Regenerative und zelluläre Therapien gegen Schmerzen im Knie sind dringend erforderlich, sowohl zur Behandlung von Knieverletzungen als auch für altersbedingte degenerative Knieprobleme. Die Behandlung von Knieproblemen gehört zu den am häufigsten angewandten und erforschten Bereichen für stammzellbasierte Therapien. ANOVA bietet ein einzigartiges Therapieprogramm aus Knochenmarkkonzentrat und PRP-Injektionen. Unsere Therapieprogramme basieren auf Ihrem individuellen Zustand und sind auf eine optimale regenerative Wirkung für Sie ausgelegt.
Diagnostik und Stammzellbehandlungen
bei Knieverletzungen, Bänderrissen und Meniskusschäden
Knieoperationen sollten oft als letzte Behandlungsoption betrachtet werden, nachdem die Ergebnisse der Diagnostik sorgfältig überprüft wurden und nachdem alle herkömmlichen und regenerativen Optionen keine Erfolge erzielt haben. Eine Ausnahme stellen hier die Kreuzbandrisse dar. Auf dieser Seite informieren wir Sie unter anderem über folgende Themen zu Knieverletzungen, Knieprobleme, Bänderrisse, Meniskusschäden, Kniearthrose, Gonarthrose, Schmerzen im oder am Knie, Gelenkersatz für Kniegelenke, Endoprothesen etc.
Springen Sie direkt zu folgenden Themen:
- Konventionelle Therapien
- ANOVA Behandlungsmöglichkeiten
- Erwartungen an eine Stammzell-Therapie
- Gelenkersatz vermeiden
- Statistiken zum Gelenkersatz
- Unsere Behandlungsmöglichkeiten bei Knieerkrankungen
- Diagnostik der Schmerz-verursachenden Defekte
- Wichtige Punkte zum Ablauf einer Behandlung
- Andere wichtige Therapieansätze
- Häufig gestellte Fragen
Folgende Knie-Erkrankungen behandeln wir u.a.:
- Knie-Arthrose (mehr zu Arthrose finden Sie auf der Arthrose und Arthritisseite
- Knie-Arthritis
- Meniskus-Risse
- Dehnungen und Risse des vorderen und hinteren Kreuzbands
(ACL, MCL, PCL oder LCL) - Knieinstabilität
- Patellofemorales Schmerzsyndrom / Chondromalazie
(Schmerzen der Kniescheiben) - Pes anserinus-Syndrom / Gänsefuß, Baker-Zyste
- Patellarsehnenentzündung, Kniesehnen-Tendinopathie,
- Insertions-Tendinopathie (“Sehnenleiden”) des (Ober)schenkelbeugers (Bizeps Femoris Insertionstendinopathie)
- Schwellungen und Entzündungen nach einer Operation (Regenerations-Beschleunigung)
Allgemein verfügbare konventionelle Therapien
Je nachdem welchen Ursprung Ihre Knieverletzung hat, stehen Ihnen verschiedene Konventionelle Behandlungsmöglichkeiten offen. In frühen Stadien werden Arthrose und Arthritis sowie Meniskusbeschwerden oft medikamentös behandelt (Schmerzmittel und Entzündungshemmer). In späten Stadien, also wenn nach einigen Jahren die Schmerzen doch unerträglichwerden, bleibt meist nur noch ein künstlicher Gelenkersatz (Endoprothese, Teil-Endoprothese). Der Gelenkersatz stellt jedoch eine große Belastung dar, die Rehabilitation ist langwierig und die Erfolgschancen sind deutlich schlechter als z.B. bei Hüftgelenksersatz. Wenn als Ursache Ihrer Kniesymptomatik bereits Arthrose oder Arthritis diagnostiziert wurde, können Sie auf unserer Arthrose und Arthritisseite mehr erfahren. Ein nur partieller (teilweiser) Kreuzbandanriss wird oft nur mittels Physiotherapie behandelt, weil eine Abheilung mit ausreichender Stabilisierung erwartet wird. Risse des vorderen Kreuzbands werden bei sehr aktiven Menschen und Sportlern operiert, bei weniger aktiven Patienten dagegen meist nur konservativ behandelt. Risse im hinteren Kreuzband sind deutlich schwieriger zu operieren und daher wird diese OP nur von wenigen, sehr spezialisierten Kliniken angeboten. Die Rehabilitation nach einem Kreuzbandriss kann 6 bis 12 Monate dauern. Intensive Physiotherapie sollte früh beginnen und die Heilung begleiten. Entzündungen und Schmerzen der Kniescheibe oder Patellarsehne werden ebenfalls häufig medikamentös oder operativ behandelt. Behandlungen mit Schmerzmitteln und Entzündungshemmern (NSIAD, Antiphlogistika) können jedoch oft keine dauerhafte Besserung erzielen. Gelenk- oder Band- und Sehnenersatz ist in vielen Fällen notwendig, führt jedoch häufig nicht zu einer vollen Wiederherstellung der Belastbarkeit.
Stammzell-Behandlungen für Kniebeschwerden
ANOVA Institue for Regenerative Medicine in Offenbach, Deutschland
BMC - PRP
Wirkhypothese bei Stammzellbehandlungen
Stammzellen haben ein großes Potential die Immunzellen, die bei einem Defekt eine Entzündung - und damit den Schmerz - auslösen, zu hemmen. Hierdurch kann die Entzündung unterbunden werden und der Schmerz lässt - häufig sofort - nach. Nachfolgend können die Stammzellen die Regeneration des Gewebes anregen und so weitere Schädigungen unterbinden und eine Heilung fördern. Ja nach individueller Problematik kann so der Schmerz ursächlich behandelt, die Regeneration beschleunigt oder ein Gelenkersatz aufgeschoben werden.
Kann man Schmerzen lindern und gleichzeitig Gelenkersatz oder Operationen vermeiden?
Ja, denn es gibt verschiedene innovative (experimentelle) Behandlungsansätze, um durch gezielte Stammzellen-Therapie am Knie-Defekt eine Operation längerfristig aufzuschieben oder sogar ganz zu vermeiden. Viele internationale, wissenschaftliche Studien haben eine signifikante Verbesserung der Kniefunktion und Schmerzreduktion unter Verwendung von Stammzelltherapien gezeigt. Jeder Fall muss allerdings individuell und sorgfältig bewertet werden, denn in einigen Fällen kann beispielsweise auch eine Operation in Kombination mit einer Stammzellbehandlung die beste Lösung sein.
Die ANOVA bietet die neuesten und fortschrittlichsten Behandlungsoptionen mittels Stammzellen an, die den Aufschub einer solch konservativen Therapie bis hin zu einer Vermeidung des künstlichen Gelenkersatzes erzielen können.
Gelenkersatz vermeiden
ANOVA IRM - Deutschland
Zwei angestrebte Effekte: Schmerzlinderung und Verlaufsverbesserung / schnellere Heilung
Der Einsatz von Stammzellen bei der Behandlung von Knieproblemen hat zwei Hauptziele: die Bekämpfung der Ursache Ihrer Schmerzen und die Förderung der Regeneration. Durch eine natürliche, örtlich gebundene Hemmung der Immunreaktion stoppt oder vermindert die Stammzellen-Injektion die entzündliche Immunreaktion im Knie. Da diese, vor allem in frühen Stadien, oft die eigentliche Ursache für Schmerzen ist, kann so eine sofortige oder sehr schnelle Abmilderung des Schmerzes bis hin zur kompletten Schmerzfreiheit des Knies erzielt werden.
Bei degenerativen Erkrankungen wie Arthrose und Arthrits kann nach der Hemmung der Entzündung durch die Stammzellen die Regeneration gerfördert werden und so eine Verlangsamung des Fortschreitens erreicht werden. Eine vollständige Heilung ist derzeit mit keiner weltweit verfügbaren Therapie möglich. Bei Rissen oder Dehnungen der Bänder und Sehnen sowie nach Operationen zur Wiederherstellung von Bändern können die Stammzellen die Abheilung fördern und so eine schnelle Rehabilitation unterstützen.
Wie behandeln wir ? Individuelle Behandlungskonzepte
Alle Therapiekonzepte der ANOVA sind individuell auf Sie als Patienten zugeschnitten. Wir berücksichtigen Ihre Vorgeschichte, Ihre Wünsche und Ihren spezifischen Krankheitsverlauf. Je nach Art und Schwere des Defekts sowie akuter oder chronischer Ursache, stellen wir Ihnen einen optimalen Behandlungsplan zusammen. Dieser kann eine einmalige Behandlung oder eine mehrfache Stammzellbehandlung sowie weitere Therapieformen beinhalten. Folgende Therapieformen wenden wir bei Knieverletzungen an:
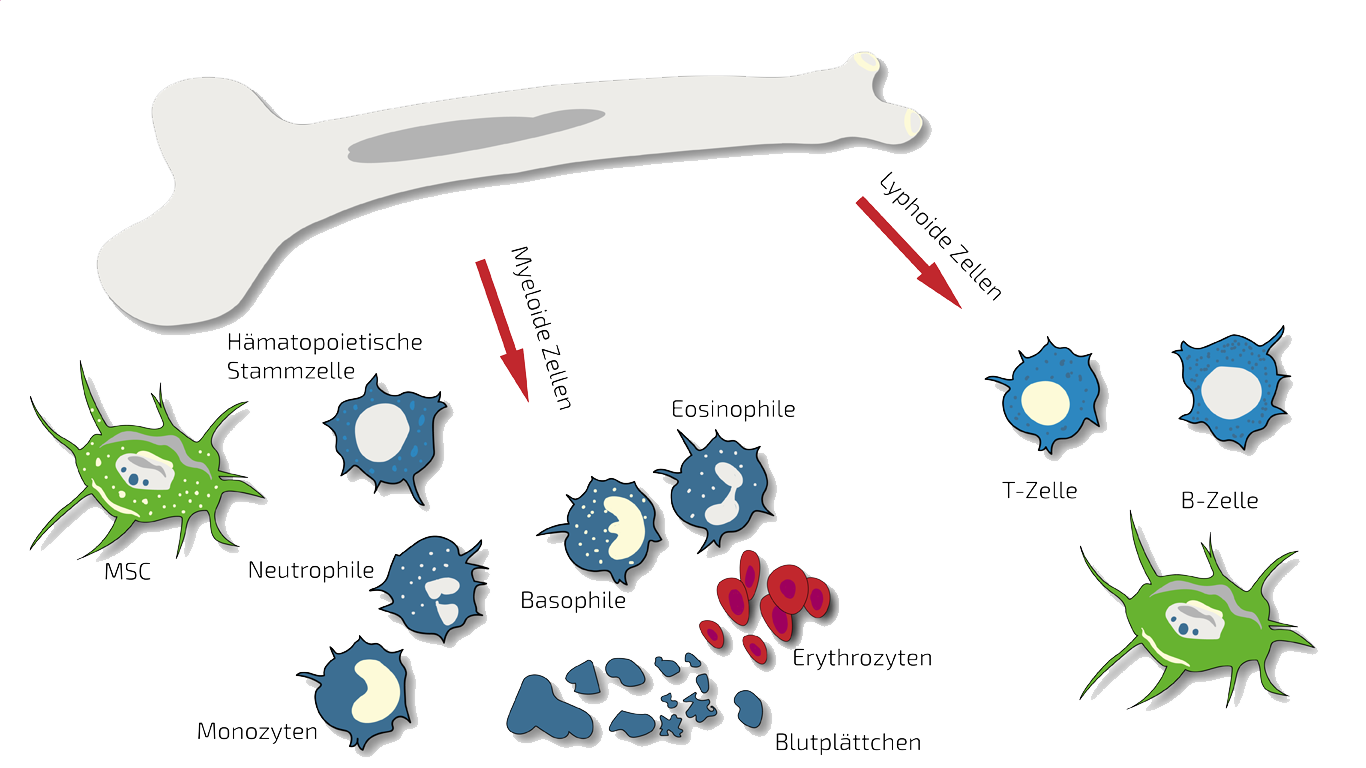
BMC - Knochenmark-Stammzellen
In der Regel ist BMC unser Therapeutikum der Wahl bei Knie-Problemen mit verschiedenen Ursachen. Da hier oft eine auf ein Gelenk beschränkte Erkrankung gegeben ist, behandeln wir an oder in Ihrem Knie genau die Stelle, die behandelt werden muss. BMC enthält eine natürliche Mischung sogenannter autologer (körpereigener) Stammzellen. Diese entnehmen wir in einer schnellen und unkomplizierten Knochenmarkpunktion aus Ihrem Beckenkamm.
Diese Stammzellen sollen die Entzündung schnell eindämmen und so Ihren Schmerz lindern sowie die Regeneration fördern. Für eine mehrfache Behandlung kombinieren wir BMC-Gaben oft mit PRP oder Hyaluronsäure (s.u.). Mehr über diesen Typ Stammzellen finden Sie hier: BMC. Für weiterführende Informationen über unsere Stammzellen-basierten Behandlungen für Arthrose und Arthritis kontaktieren Sie uns jederzeit.
MSEC - Sekretom mesenchymaler Stammzellen – Exosomen
Bei Knieverletzungen setzen wir das Sekretom mesenchymaler Stammzellen selten ein, da das Sekretom eher für Krankheiten mit zahlreichen Problemstellen oder zentraler Ursache (wie z.B. dem Immunsystem) im Körper geeignet ist.
Bei Arthritis jedoch kann Sekretom (Exosomen) intravenös zur langfristigen Behandlung empfehlenswert sein.
Mehr über Sekretom/Exosomen finden Sie auf unserer Sekretom-Therapieseite.
PRP - Plättchen-reiches Plasma, platelet-rich plasma
PRP ist eine vergleichsweise einfache experimentelle Therapie, da hier nur Blutplättchen (sogenannte Throbozyten) aus Ihrem Blut, aber keine Stammzellen isoliert werden. Sie dienen der Unterstützung der Wundheilung und der Förderung des Zellwachstums. PRP wird jedoch bei alleiniger Gabe keine große Wirkung auf entzündliche Reaktionen zugesprochen.
Daher wenden wir PRP bei Knieverletzungen eher als Kombinationstherapie mit BMC an.
Mehr zu PRP (als Kombinationstherapie) finden Sie auf unserer PRP-Therapieseite.
Hyaluronsäure - HA
Eine weitere unterstützende Therapieform ist die Injektion von Hyaluronsäure ins Gelenk.
Dies vermindert ebenfalls Schmerzen und führt zu einer besseren "Schmierung" der Gelenke. Hyaluronsäure allein hat jedoch kaum regenerative Effekte.
Daher kombinieren wir die Behandlung meist mit einer BMC-Behandlung.
Hyaluronsäure - ANOVA IRM - Deutschland
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
Regeneration von Knieverletzungen mit Stammzellen:
Kehren Sie mit oder ohne Operation schneller in Ihren Alltag zurück

Eine Stammzelltherapie kann Ihnen dabei helfen, ohne Operation nach einem Bänder- oder Sehnenriss schneller in den Alltag zurück zu kehren. Aber auch nach einer Operation kann eine Stammzellbehandlung die Regeneration fördern und die Heilung beschleunigen. Lassen Sie sich von uns zu Ihrem spezifischen Fall beraten!
Was machen wir anders?
Diagnostik – Wir suchen die Ursache Ihres Schmerzes
Prof. Dr. Stehling, der Gründer der ANOVA IRM ist Radiologe und promovierter Physiker. Aus diesem Grund verfügt das ANOVA Institute for Regenerative Medicine in Kooperation mit dem im selben Gebäude befindlichen Prof. Stehling Institut für bildgebende Diagnostik über die Möglichkeit, spezielle Präzisionsdiagnostik wie Arthro-MRT und nicht-radioaktive Kontrastmittel-MRTs anzuwenden.
Im Vergleich zu vielen konventionellen MRTs, sind diese Methoden oft in der Lage, die Schmerz-verursachende Entzündung am oder im Wirbel zu lokalisieren. Hierdurch sind wir in der Lage individuell festzulegen, wie Patienten behandelt werden und wo die Stammzellen angewendet werden sollen.
Darüber hinaus ergänzen wir in Absprache mit Ihnen unsere patientenindividuelle Diagnostik durch spezifische Blutuntersuchungen zu Hormonen, Entzündungsparametern und anderen Faktoren, die in Ihrem Fall wichtig sind oder empfehlen Ihnen weitere Untersuchungen wie z.B. einen präventiven MRT-Wirbelsäulenscan.

Diagnostik-Teil-Körper-MRT
ANOVA IRM © Siemens Healthcare GmbH
Was machen wir anders?
Wir bringen die Stammzellen präzise dahin, wo sie gebraucht werden

CT-gesteuerte Injektion von Stammzellen in Gelenke - ANOVA IRM -Deutschland
Im Gegensatz zu vielen anderen Kliniken haben wir in unserer Praxis in Offenbach die Möglichkeit die Stammzellen bildgestützt - also unter Ultraschall oder CT - direkt in Ihr betroffenes Knie zu injizieren (intraartikuläre Gabe). D.h. wir bringen die Stammzellen direkt und konzentriert an den Ort, an dem Sie Schmerzen haben und Entzündungen vorliegen.
Eine rein intravenöse Gabe, wie viele andere Kliniken sie durchführen, erfolgt nur für das Sekretom (Exosomen), wenn dieses zusätzlich unterstützend oder präventiv verwendet werden soll, weil an mehreren Stellen im Körper Gelenkbeschwerden gegeben sind.
Viele internationale wissenschaftliche Studien haben eine signifikante Verbesserung der Kniefunktion und Schmerzreduktion unter Verwendung von Stammzelltherapien gezeigt. Weitere Informationen finden Sie im Abschnitt Referenzen und Literatur.
Sie wollen eine Zweitmeinung zu Ihrem Befund?
Sind Sie unsicher?
Vereinbaren Sie einen Beratungstermin!
Wir begutachten gerne Ihre bisherigen medizinischen Unterlagen und Befunde sowie Bilder (MRT, Röntgen, CT). Dies erfolgt immer, wenn Sie an einer Behandlung interessiert sind, aber wir beraten Sie auch, wenn Sie eine Zweitmeinung zu Ihrer konservativen Behandlung wünschen. Nutzen Sie unsere diagnostische Kompetenz! Unsere Patientenbetreuer informieren Sie darüber, welche Informationen wir vorab benötigen, wie Sie uns Ihre Unterlagen zukommen lassen können, und terminieren dann einen Beratungstermin mit unseren Ärzten. Bitte nutzen sie unser Kontaktformular um eine schnelle Bearbeitung zu erleichtern. Der Beratungstermin kann über eine Videokonferenz oder telefonisch erfolgen. Wenn Sie eine intensivere Beratung oder zusätzliche diagnostische Untersuchungen wünschen, können Sie auch einen persönlichen Beratungstermin vor Ort in Offenbach vereinbaren. Alle Gespräche mit unseren Patientenbetreuern und wissenschaftlichen Experten sind kostenfrei. Sie werden bei Arztgesprächen vorab über entstehende Kosten informiert.

Gelenkersatz vermeiden
ANOVA IRM - Deutschland
Ablauf der Stammzelltherapie bei Knieverletzungen
Den genauen Ablauf der unterschiedlichen Behandlungsarten finden Sie auf den jeweiligen Seiten der Therapien mit BMC (am häufigsten verwendet) Sekretom/Exosomen und PRP (als Kombinationstherapie).
Jede Behandlung gliedert sich in die allgemeine Befundaufnahme (wir analysieren Ihre bisherige Medikation und Befunde), Vorgespräche und Arztgespräch inklusive der Beratung zu möglichen Therapieoptionen und ärztlichen Einschätzung des Nutzens einer Stammzellbehandlung (Indikationsstellung) in Ihrem speziellen Fall. Sollten Sie sich nun für eine Stammzellbehandlung entscheiden, folgen Voruntersuchungen, gegebenenfalls weiterführende Diagnostik, nochmalige Beratung zu allen Therapie-Optionen, Erstellung eines individuellen Behandlungsplans inkl. Kostenvoranschlag, Entnahme von Gewebe, Herstellung des Stammzellproduktes, Qualitätskontrolle des Produktes und Anwendung. Bei Knieverletzungen gibt es zwei Besonderheiten. Sofern Ihre bisherigen CTs oder Röntgenuntersuchungen nicht die spezifischen Ursachen Ihrer Gelenkschmerzen gefunden haben, untersuchen wir Sie vorab mit einem aussagekräftigen Arthro-MRT oder einem MRT mit nicht-radioaktivem Kontrastmittel, sofern Sie dies wünschen. Darüber hinaus wenden wir Stammzellen (BMC) oft direkt im Knie-Gelenk (intraartikulär) an. Dies bedeutet, dass wir die Stammzellen genau an den Ort bringen, an dem Ihre Schmerzen entstehen.
Leider können wir gemäß des Nutzen-Risiko-Verhältnisses keine Kinder oder schwangere Frauen behandeln. Darüber hinaus können auch andere Faktoren als Ausschlusskriterien bewertet werden.
Wie lange dauert eine Stammzellbehandlung
Die Behandlung gliedert sich in die Prüfung Ihrer Unterlagen (Vor-Anamnese), Arztgespräch, Beratung dazu, ob unsere Therapien sich für Sie eignen und Erfolgsaussichten bestehen, die Festlegung der Behandlungsform sowie die Terminvereinbarung. Dies erfolgt, wenn Sie weiter entfernt wohnen, ohne dass Sie nach Offenbach (bei Frankfurt/Main, Deutschland) reisen müssen. Wenn Sie dies bevorzugen, führen wir die initialen Gespräche telefonisch oder per Videokonferenz durch. Für die eigentliche Behandlung reisen Sie nach Offenbach. Dann dauert die Entnahme, Qualitätskontrolle und Behandlung je nach Therapie wie folgt:
BMC- und PRP-Behandlung
Voruntersuchungen, Entnahme und Anwendung von BMC oder PRP vor Ort einmalig 2 Tage (aufeinander folgende Tage).
Sekretom/Exosomen-Behandlung:
Vorbereitung und Entnahme des Fettes (Mini-Liposuktion) einmalig 2 Tage (aufeinander folgende Tage) in Offenbach, daran schließen sich die Anreicherung der mesenchymalen Stammzellen (Sekretom/Exosomen) und intensive Qualitätskontrolle (gemäß pharmazeutischer Vorgaben) an. Ca. 4 Wochen nach der Entnahme beginnt die Therapie gemäß dem mit Ihnen festgelegten Therapieplan. Sie kommen dann mehrfach für die Anwendung nach Offenbach am Main (Deutschland). Die Haltbarkeit des Sekretoms (Exosomen) beträgt 2 Jahre.
Was kostet eine Stammzell-Behandlung?
Unsere Stammzelltherapien sind immer auf Ihre spezielle Situation, Krankheit, das Stadium und weitere Faktoren zugeschnitten. Die Therapien unterscheiden sich im verwendeten Produkt (BMC, Sekretom, PRP oder Hyaluronsäure), der Häufigkeit der Behandlung sowie den weiteren Untersuchungen und Ihren Sedierungs- und Narkosewünschen. Eine Behandlung kann bei Knieverletzungen wenige Hundert bis mehrere Tausend Euro kosten. Sie erhalten für Ihre Behandlung vorab einen Kostenvoranschlag, damit Sie vor Beginn der Behandlung genau wissen können, was in Ihrem individuellen Fall eine Behandlung kosten würde.
Bezahlt die Krankenkasse meine Stammzell-Behandlung?
Im Moment ist leider anzunehmen, dass Ihre Krankenkasse Kosten der experimentellen Therapien (BMC, Sekretom, PRP, Micro-Fracture technique) nicht übernimmt. Dies bedeutet, dass Sie die Kosten vollständig selbst tragen müssen.
In den letzten Jahren zögern orthopädische Chirurgen immer häufiger, wenn es darum geht, Patienten Operationen zu empfehlen. Warum? Die Ergebnisse für viele Arten von Knieoperationen sind alles andere als überzeugend. Hier einige Forschungsergebnisse:
- 95% erreichen durch Hüftersatz nicht das normale Aktivitätsniveau zurücki
- 54% leiden fünf Jahre nach einer Knieersatzoperation unter Schmerzeniii
- 60% der Knieersatzoperationen haben keine eindeutige medizinische Indikationiv
- 27% der Hüftersatzpatienten haben noch einige Jahre nach der Operation Schmerzenv
- 47% der Knieersatzpatienten nehmen im Jahr nach Ihrer Operation Schmerzmittel einvi
- 4% Anstieg des Risikos für Hüftfrakturen während 10 Jahren nach einer Knieersatzoperationvii
- 200% und 600% erhöhten das Risiko von Magenblutungen nach einem retrospektiven Knie- und Hüftersatzviii
- Anstieg des Herzinfarktrisikos um 3100% in den ersten zwei Wochen nach Knieersatzix
- Anstieg des Herzinfarktrisikos um 2600% in den ersten zwei Wochen nach einem Hüftersatzv
- Die MRT, das wertvollste diagnostische Instrument in der Orthopädie, kann die Ursache von Schmerzen oder Verletzungen in dieser Region aufgrund magnetischer Interferenzen nicht mehr bestimmen.
- Raucher haben ein besonders hohes Risiko: + 161% Schlaganfallwahrscheinlichkeit, + 53% Infektionswahrscheinlichkeit, + 34% Lungenentzündungswahrscheinlichkeit, + 63% Wahrscheinlichkeit zu sterben innerhalb des ersten Jahres nach der Operation.x
Andere wichtige Therapieansätze bei Knieverletzungen und -Erkrankungen
Das Knie ist ein komplexes und vielseitig belastetes Gelenk. Daher ist es wichtig jede Therapie auch mit konventionellen Ansätzen wie Physiotherapie und sobald möglich Bewegungssport zu kombinieren. Wir koordinieren unsere Behandlungen gerne mit Ihrem Hausarzt oder Orthopäden bei Ihnen vor Ort. Darüber hinaus beraten wir Sie gerne zu Nahrungsergänzungsmitteln oder Infusionstherapien, die Ihre Behandlung unterstützen könnten. Verschiedenen Stoffen wird eine entzündungshemmende oder regenerationsfördernde, unterstützende Funktion zugeschrieben.
Physiotherapie, Manuelle Therapie, Osteopathie, Einlagen
Eine orthopädische Behandlung sollte bei Knieverletzungen mit und ohne Operation immer erfolgen. Suchen Sie einen guten und erfahrenen Physiotherapeuten auf! Physiotherapeuten können untersuchen, ob Ihre Beine tatsächlich gleich lang sind oder ob Sie Hüftfehlstellungen haben, die eine einseitige oder falsche Belastung bewirken. Bei praktisch allen Knieverletzungen kann Muskulatur das betroffene Gelenk stabilisieren. Oftmals kann man Patienten spezielle stabilisierende Übungen zeigen, die bei regelmäßiger Durchführung zu einer Verbesserung Ihrer Bewegungsfähigkeit oder vollständigeren Rehabilitation nach Operationen führen können. Nehmen Sie gegebenenfalls Osteopathie oder manuelle Therapie in Anspruch, um vorhandene Verklemmungen und Verspannungen in der Wirbelsäule, Hüfte oder den Beinen zu lösen. Oft führen Schmerzen zu Schonhaltungen oder sogar Fehlhaltungen, die weitere Probleme auslösen.
Bewegungssport
In vielen Fällen hat moderater Bewegungssport sehr positive Einflüsse auf den Verlauf oder die Rehabilitation bei Knieverletzungen und Kniearthrose. Ihr Bewegungsprogramm sollte jedoch immer in Absprache mit einem kompetenten Physiotherapeuten erfolgen, da die Belastung je nach Behandlungsform langsam gesteigert werden sollte. Bei Kniearthrose ist regelmäßiges Fahrradfahren sehr erfolgversprechend. Lassen Sie jedoch vorab in einem Fahrradladen Ihre Sattelhöhe einstellen, damit keine Fehlbelastung auftritt. Schwimmen ist bei Knieverletzungen zu Anfang meist nicht empfehlenswert, da eine Drehung im Gelenk häufig nicht ganz vermeidbar ist. Auch Wandern oder Nordic Walking können sich sehr positiv auswirken.
Nahrungsergänzung und Ernährung
Die Wirkung von Nahrungsergänzungsmitteln und Ernährungsumstellung ist viel diskutiert. Allerdings stellen sie einfache und kostengünstige Möglichkeiten dar, selbst etwas zu tun. Eine Umstellung der Ernährung auf fleischarme und gemüsereiche Kost kann bei entzündlichen Knieerkrankungen helfen. Alkohol und Niktoin sollten bei Arthrose, Arthritis und Meniskuschäden vermieden werden, da sie die Knorpelzellen schädigen. Entzündungshemmende Nahrungsergänzungsmittel werden häufig diskutiert, wenn akute Schwellungen und Entzünduungen nach Verletzung oder OP vorliegen. Hierzu gehören unter andrem Omega-3 Fettsäuren, Kurkumin (Kurkuma), Chondroitinsulfat, MSM, Grünlippmuschelextrakt, Hyaluronsäuren etc.
Häufig gestellte Fragen:
Stammzellbasierte Therapien zur Behandlung von Knieverletzungen
Weitere Informationen finden Sie auch in unserem allgemeinen Blogpost zu Arthrose.
Welche Risikofaktoren für Knieverletzungen gibt es?
Risikofaktoren für Knieverletzungen sind:
- Trauma (Unfall)
- Überbelastung oder Fehlbelastung der Gelenke durch bestimmte Berufe oder Sportarten
- Höheres Alter
- Mangelnde Fitness
Was ist ein Meniskusriss? Wie fühlt sich ein Meniskusriss an?
In jedem Knie befinden sich innen und außen je ein Meniskus. Diese Menisken stellen jeweils ein Stück Knorpel im Knie dar, das sozusagen als Stoßdämpfer zwischen dem Oberschenkelknochen (Femur) und dem Schienbein (Tibia) wirkt. Die Menisken werden bei jeder Beugung und Streckung des Knies im Besonderen aber bei Bewegungen, die starken Druck ausüben oder das Knie drehen, beansprucht. Beispiel für starke Belastungen sind z.B. beim Treppensteigen, beim tiefen Kniebeugen und bei schnellen Sportarten wie Fußball, Tennis oder Joggen. Bei abrupten Bewegungen ist die Beanspruchung besonders hoch. Meniskusverletzungen können mit zunehmendem Alter durch anhaltende, langjährige Belastung, degenerative Veränderungen, Verletzungen und Risse im Meniskusgewebe auftreten. Bei jüngeren Patienten sind Meniskusschäden meist auf Sportverletzungen zurückzuführen. Wenn die Symptome, also Schmerzen und Bewegungseinschränkungen langsam zunehmen, ist die Verletzung meist auf Verschleiß zurückzuführen.
Ein Meniskusriss verursacht meist Schmerzen, Schwellungen des Knies und Steifheit. In manchen Fällen fühlt sich das Knie auch blockiert an und Beugung ist nicht gut möglich. Bei Verletzungen des Innenmeniskus verstärkt sich der Schmerz meist bei Drehbewegungen oder starker Beugebelastung. Wenn jedoch der Außenmeniskus verletzt ist, wird das Knie stark druckempfindlich. In manchen Fällen treten bei Meniskusschäden knackende oder schnappende Geräusche auf. In vielen Fällen fühlt sich das Knie instabil an.
Was ist ein Riss des vorderen Kreuzbands? Was ist ein ACL?
Das vordere Kreuzband (lateinisch Ligamentum cruciatum anterius, VKB oder LCA bzw. ACL) ist mittig an der Vorderseite des Kniegelenks (Area intercondylaris anterior, AIA) angeheftet. Es verbindet die beiden knorpelfreien Kreuzbandhöcker (Tuberculum intercondylare mediale) des Schienbeinkopfes mit dem Knie und ist ein wichtiger Stabilisator im Kniegelenk. Das vordere Kreuzband ist ca. 2 cm lang und 8 mm dick. Es stabilisiert das Knie im Zusammenspiel mit dem hinteren Kreuzband, dem medialen (mittigen) Seitenband und dem lateralen (seitlichen) Seitenband. Vor allem bei Sportarten mit schnellen Richtungswechseln wie Fußball, Basketball, Ultimate Frisbee etc. treten Verletzungen am vorderen Kreuzband häufig auf. Bei Skifahrern kommen Kreuzbandrisse ebenfalls häufig vor. Hier jedoch meist infolge einer Überdrehung bei Stürzen. Solche Drehbewegungen im Knie und ruckartige Richtungsänderungen überlasten das vordere Kreuzband sehr schnell.
Für einen Riss des vorderen Kreuzbandes ist es typisch, dass ein plötzlicher Schmerz mit anschließender starker Schwellung auftritt. Eine Belastung des Knies ist meist nicht mehr möglich und Betroffene nehmen oft eine Schonhaltung ein. Bei sehr starker Muskulatur können die Schmerzen geringer sein und Bewegungseinschränkungen nicht sofort in vollem Ausmaß wahrgenommen werden. Die Diagnose erfolgt über den sogenannten Schubladentest, bei dem das Knie gegen den Oberschenkel verschoben wird. Ist dies möglich, liegt ein Meniskusriss vor. Sollten Sie sehr sportlich sein und nach einem Sturz oder einer Bewegung starke Schmerzen im Knie haben, aber Ihr Orthopäde stellt keinen Kreuzbandschaden fest, lassen Sie ein MRT anfertigen, um dies abzusichern. Manchmal werden Kreuzbandrisse ohne MRT erst nach 3-4 Monaten diagnostiziert, wenn die Muskulatur durch den Bewegungsmangel rückgebildet ist. Darüberhinaus kann ein MRT zeigen, ob das Kreuzband überdehnt, angerissen oder gerissen ist. Diese Informationen sind notwendig, um eine für diesen Fall sinnvolle Behandlung festzulegen.
Was ist Gonarthrose?
Der durch Arthrose verursacht Verschleiß am Knie-Gelenk wird in der Medizin als Gonarthrose bezeichnet. Da das Knie ein stark beanspruchtes Gelenk ist, ist die Kniearthrose die häufigste abnutzungsbedingte Form des Gelenkverschleißes. Mehr zu Arthrose finden Sie auf unserer Arthrose und Arthritisseite . Meist altersbedingter Gelenkverschleiß führt dazu, dass der Knorpel im Knie zerstört wird. Vorherige Bänderrisse, Meniskusschäden oder Überbelastung können Kniearthrose jedoch auch begünstigen. Im Verlauf der Krankheit verringert sich durch die Entzündungen die Menge an Knorpel zunehmend und die Bewegung des Knies wird immer schmerzhafter. In vielen Fällen wird die Bewegung immer weiter eingeschränkt und es bleibt nur ein Gelenkersatz. Der Gelenkersatz für Knie ist jedoch nicht so erfolgreich wie ein Hüftgelenksersatz. Daher sollte bei Kniearthrose frühzeitig interveniert werden und mit Medikamenten, Physiotherapie oder Stammzellbehandlungen das Fortschreiten abgemildert werden.
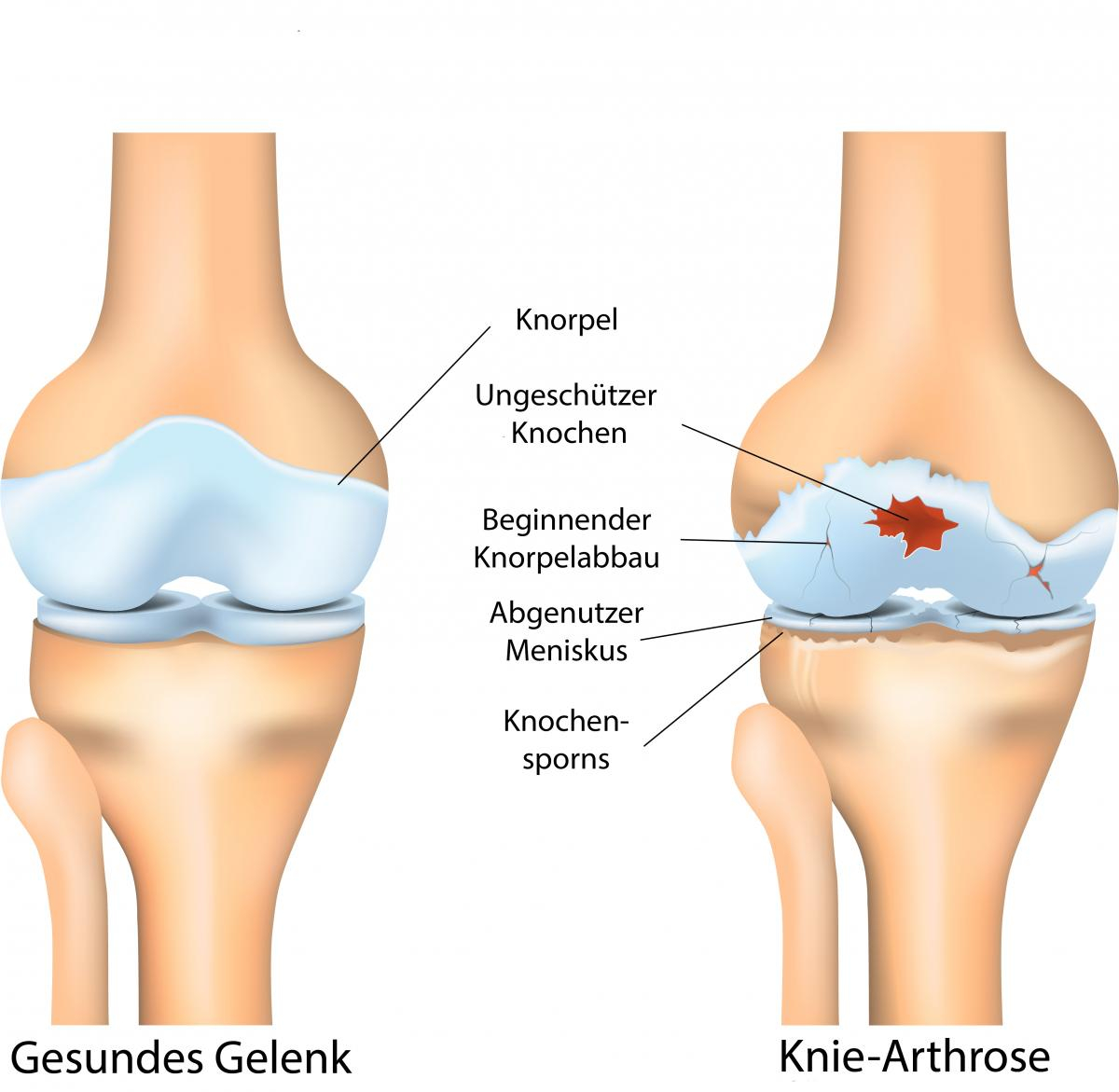
Gelenkschäden bei Arthrose und Arthritis
ANOVA IRM - Deutschland
Ist Arthrose genetisch bedingt? Ist Arthrose vererbbar?
Laut Studien, die vom NCBI veröffentlicht wurden, spielt die Genetik, also die Vererbung, bei Arthrose ebenfalls eine Rolle. Wenn Arthrose in einer Familie auftritt, wird das Risiko der Kinder, später im Leben ebenfalls an Arthrose zu erkranken, auf ca. 35 bis 65% geschätzt. Dieses erhöhte Risiko, auch familiäre Häufung, bedeutet aber nicht, dass jeder an Arthrose erkrankt, dessen Eltern oder Großeltern Arthrose hatten. Evidenzbasierte Studien, die vom NCBI veröffentlicht wurden, zeigen außerdem, dass für verschiedene Körperteile die Wahrscheinlichkeit der familiären Häufung unterschiedlich ist. Beispiele hierfür sind eine 40%-ige Wahrscheinlichkeit für Arthrose im Knie, aber bei der Hüfte und den Händen liegt die Wahrscheinlichkeit bei 65%.
Wissenschaftler arbeiten derzeit durch die Analyse von Genomen und Biobankdaten daran mehr über die Vererbbarkeit von Arthrose zu erfahren.
Welche Behandlungsmöglichkeiten gibt es für Arthrose?
Ärzte und Kliniken kombinieren häufig mehrere Behandlungsebenen, um die Therapie auf den Patienten abzustimmen.
Zwei Hauptziele der Behandlung von Arthrose und Arthritis:
- Schmerzkontrolle
- Verbesserung oder Erhalt der Gelenkfunktion
Therapien für Arthrose und Arthritis können u.a. umfassen:
- Schmerztherapie, meist über Medikamente
- Medikamentöse Behandlung der Entzündungen
- Physiotherapie, Gymnastik, Übungen für die Tiefenmuskular
- Maßnahmen zur Gewichtskontrolle und Umstellung der Ernährung
- Diäten, ballaststoffreiche Lebensmittel, Obst und Gemüse. Einige Nahrungsergänzungsmittel scheinen hilfreich zu sein.
- Maßnahmen zum Stressabbau
- Stammzelltherapien
- Komplementäre und alternative Therapien
- Gelenkersatz mit Endoprothesen
Was sind die Risikofaktoren von Arthrose?
Zu Risikofaktoren bei Arthrose haben wir einen separaten Blog-Beitrag geschrieben.
Helfen präventive MRT-Untersuchungen schwere Schäden zu vermeiden?
In vielen Bereichen werden präventive diagnostische Untersuchungen von den Krankenkassen nicht bezahlt. Diese werden dann nur Privatpatienten oder Selbstzahlern angeboten (IGeL-Leistungen, Selbstzahler-Leistungen). Gerade in Bezug auf Knieprobleme sowie Arthrose und Arthritis ist eine frühzeitige Erkennung jedoch ein wichtiger Grundstein, um möglichst schwerwiegende Schäden und starke Schmerzen zu verhindern und damit die "Endstation" Gelenkersatz mit all Ihren Problematiken, Risiken und Nebeneffekten zu vermeiden. Also selbst wenn Ihre Krankenkasse die Kosten nicht übernimmt, sollten Sie sich unabhängig beraten lassen, ob ein präventives MRT für Sie hilfreich sein könnte.
Wofür gibt es präventive MRT-Untersuchungen?
Präventive MRT-Untersuchungen sind in vielen Fällen hilfreich. Da keine Strahlenbelastung gegeben ist, können MRTs zur frühzeitigen Diagnose von Arthrose, Arthritis, Sehenenrissen, Bänderrissen und Kapselrissen eingesetzt werden. MRTs sind auch wichtige diagnostische Hilfen bei der Früherkennung von Brustkrebs (Mammakarzinomen) und Prostatakrebs (Prostatakarzinomen). Ganzkörper-MRTs können eingesetzt werden, um eine Früherkennung von Prostatakrebs zu gewährleiten oder Metastasen in Weichgeweben zu lokalisieren. Oft erkennt ein MRT Metastasen früher als ein CT oder eine Röntgenaufnahme.
Wie wirkt Kortison - Cortisone
Das Spritzen von Kortison- und verwandten Präparaten (Kortikoide) in oder an entzündete Gelenke, Bänder und Sehnen wird auch heute noch weitverbreitet eingesetzt. Dies führt typischerweise zu einer schnellen Schmerzlinderung, weil die Entzündung gehemmt wird, die Wirkung ist jedoch eher kurzfristig (bis ca. 4 Wochen). Unerwünschte Nebenwirkungen sind, dass Kortisoninjektionen den Gelenkverschleiß durch Schädigung der Knorpelzellen auf Dauer beschleunigen. Der NDR hat zu Kortison eine unabhängige Recherche publiziert.
Wann brauche ich einen Gelenkersatz?
Verletzungen von Sehnen und Bändern verursachen im Normalfall keine Notwendigkeit für einen Gelenkersatz. Sehr starke Meniskusschädigungen dagegen werden neuerdings manchmal mittels eines operativen Einsatzes von künstlichen Menisken therapiert. Die Implantate bestehen häufig aus resorbierbarem (biologisch abbaubarem) Kollagen und dieses dient als Gerüst für das Einwachsen körpereigener Zellen. Die Rückkehr zur normalen Funktionalität dauert ca. 6 Monate, kann aber nur erfolgreich ablaufen, wenn die Entzündungen vor der OP erfolgreichbehandelt wurden.
Arthrose- und Arthritis-Patienten brauchen momentan in späteren Stadien der Krankheit einen Gelenkersatz mit künstlichen Gelenken, sogenannten Endoprothesen, weil die konventionellen Therapien, die Krankheit nicht ausreichend aufhalten. Hüftprothesen werden mittlerweile meist erfolgreich eingesetzt, während bei Knieprothesen nach wie vor häufig Komplikationen auftreten, sodass manche Physiotherapeuten von einer Knieprothese abraten, weil sie mittels Physiotherapie ohne Gelenkersatz größere Chancen sehen, die Situation des Patienten zu verbessern. Auch ist die Lebensdauer von Endoprothesen begrenzt, da Metall und Kunststoff einem ständigen Abrieb und struktureller Ermüdung unterliegen. Dieser Abrieb wird nicht, wie bei natürlichen Gelenken, durch Umbau und Nachwachsen von Gewebe kompensiert. Darüber hinaus kann der Abrieb die Gelenke stark schädigen (vgl. NDR Reportage Metallablagerungen). So müssen viele Endoprothesen nach 10 - 20 Jahren ausgetauscht werden, was zu noch größeren Funktionseinschränkungen führt.
Was ist BMC?
Knochenmarkkonzentrat (BMC, bone marrow concentrate) wird bei einem kleinen, kurzen Eingriff mittels einer Spritze aus dem Beckenknochen entnommen. BMC ist eine Quelle für Blutstammzellen und mesenchymale Stammzellen (MSCs). Es enthält neben Stammzellen viele wichtige Wachstums- und Regenerationsfaktoren. Das Verfahren ist relativ einfach und minimal invasiv, daher war es in den letzten Jahrzehnten eine bevorzugte Quelle für stammzellbasierte Therapien. Viele Ärzte verlassen sich auf BMC als Hauptstammzellbehandlung, manchmal jedoch mit übertriebenen Behauptungen. BMC ist kein Wunderheilmittel, auch wenn in einigen internationalen Studien hoffnungsgebende Ergebnisse für die Behandlung zahlreicher Krankheiten gezeigt werden konnte, darunter auch Arthrose (OA) und Arthritis, Knieverletzungen und Herzinfarkte. Lesen Sie hier mehr über unsere BMC-Behandlung.
Was ist PRP - platelet-rich plasma?
Thrombozytenreiches Plasma (auch plättchenreiches Plasma, PRP) wird direkt aus dem Blut des Patienten gewonnen. Es ist somit ein Blutprodukt mit aus dem Patientenblut gewonnenen und aufkonzentrierten regenerativen Blutplättchen, Wachstumsfaktoren und Zytokinen. Es ist sehr einfach zu gewinnen und hat vielversprechende Ergebnisse bei der Behandlung mehrerer entzündlicher und degenerativer Erkrankungen gezeigt. Es wird z.B. sehr häufig von Zahnärzten eingesetzt, um das Anwachsen von Körperzellen an Zahnimplantaten zu fördern. Zur Behandlung akuter und chronischer Krankheiten am Knie kann es mit BMC kombiniert werden, da es synergistische Wirkungen auf den Behandlungserfolg haben kann. Lesen Sie hier mehr über unsere PRP-Behandlung.
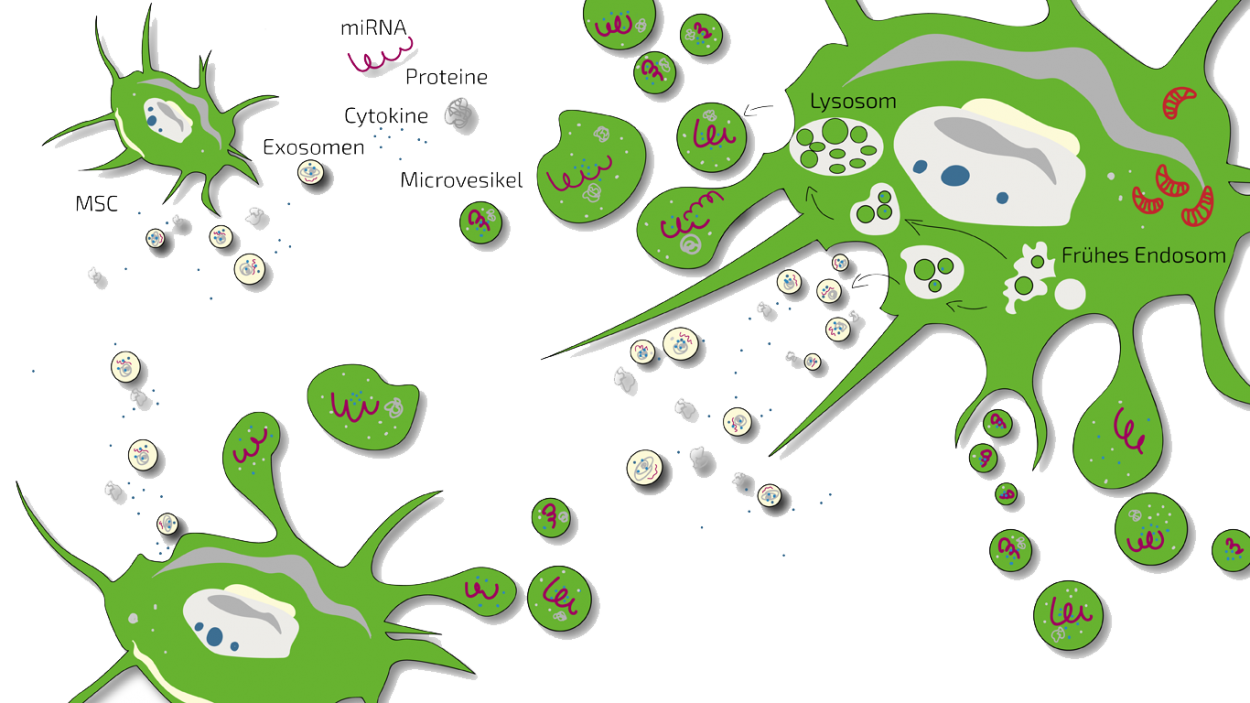
Was ist Sekretom?
Als Sekretom bezeichnet man die von Stammzellen nach außen abgegebenen Stoffe in ihrer Gesamtheit (Exosomen, Mikrovesikel, Proteine, Wachstumsfaktoren, Zytokine, Chemokine etc,). Seit Längerem ist bekannt, dass mesenchymale Stammzellen (MSCs) ihre regenerative Wirkung indirekt entfalten, nämlich durch die Abgabe einer großen Zahl von Botenstoffen, die zusammengefasst als das “Sekretom” der Stammzellen bezeichnet werden. Diese Zytokine (zelluläre Kommunikationsmoleküle), Wachstumsfaktoren (Stoffe, die die Neubildung und Regeneration von Zellen fördern können), mikroRNAs (Signal- und Steuerungsmoleküle) und entzündungshemmende Stoffe, werden entweder als wasserlösliche Moleküle oder in Exosomen, kleinen Zellmembranbläschen, eingelagert. Man geht also davon aus, dass das Stammzellsekretom (Exosomen) die Wirkung auf Knorpelzellen und somit die Gelenkknorpelregeneration bedingt, und nicht, wie früher vermutet, die Umwandlung der mesenchymalen Stammzellen in Knorpelzellen die Effekte bedingt. Die Einsetzbarkeit des mesenchymalen Stammzellsekretoms als krankheitsmodifizierendes Biologikum (DMD - disease modifying drug), wurde in der Abteilung für orthopädische Chirurgie der Erasmus Universität in Rotterdam, Holland, kürzlich an einem Arthrosemodell der Maus belegt.
- Kahn, Timothy L., and Ran Schwarzkopf. "Do Total Knee Arthroplasty Patients Have a Higher Activity Level Compared to Patients With Osteoarthritis?." Geriatric Orthopaedic Surgery & Rehabilitation 7.3 (2016): 142-147.
- Skou, Søren T., et al. "A randomized, controlled trial of total knee replacement." New England Journal of Medicine 373.17 (2015): 1597-1606.
- Metsna, Vahur, Sigrid Vorobjov, and Aare Märtson. "Prevalence of anterior knee pain among patients following total knee arthroplasty with nonreplaced patella: a retrospective study of 1778 knees." Medicina 50.2 (2014): 82-86.
- Riddle, Daniel L., William A. Jiranek, and Curtis W. Hayes. "Use of a validated algorithm to judge the appropriateness of total knee arthroplasty in the United States: a multicenter longitudinal cohort study." Arthritis & Rheumatology 66.8 (2014): 2134-2143.
- Wylde, Vikki, et al. "Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants." PAIN® 152.3 (2011): 566-572.
- Fuzier, Régis, et al. "Analgesic drug consumption increases after knee arthroplasty: a pharmacoepidemiological study investigating postoperative pain." PAIN® 155.7 (2014): 1339-1345.
- International Osteoporosis Foundation
- Lalmohamed, Arief, et al. "Changes in mortality patterns following total hip or knee arthroplasty over the past two decades: a nationwide cohort study." Arthritis & Rheumatology 66.2 (2014): 311-318.
- Lalmohamed, Arief, et al. "Timing of acute myocardial infarction in patients undergoing total hip or knee replacement: a nationwide cohort study." Archives of internal medicine 172.16 (2012): 1229-1235.
- Singh, Jasvinder A., et al. "Smoking as a risk factor for short?term outcomes following primary total hip and total knee replacement in veterans." Arthritis care & research 63.10 (2011): 1365-1374.
- Houdek MT. Mesenchymal stem cell therapy for osteoarthritis?: current perspectives. 2015:117-124.
- Tang J, Cui W, Song F, Zhai C. Effects of mesenchymal stem cells on interleukin-1 ? -treated chondrocytes and cartilage in a rat osteoarthritic model. 2015:1753-1760. doi:10.3892/mmr.2015.3645.
- Mazor M, Lespessailles E, Coursier R. Mesenchymal stem-cell potential in cartilage repair?: an update Osteoarthritis. 2014;18(12):2340-2350. doi:10.1111/jcmm.12378.
- Song F, Tang J, Geng R, et al. Comparison of the efficacy of bone marrow mononuclear cells and bone mesenchymal stem cells in the treatment of osteoarthritis in a sheep model. 2014;7(4):1415-1426.
- Ham O, Lee CY, Kim R, et al. Therapeutic Potential of Differentiated Mesenchymal Stem Cells for Treatment of Osteoarthritis. 2015;(April):14961-14978. doi:10.3390/ijms160714961.
- Kristjánsson B, Honsawek S. Current Perspectives in Mesenchymal Stem Cell Therapies for Osteoarthritis. 2014;2014. doi:10.1155/2014/194318.
- Centeno, Christopher, et al. "Efficacy of autologous bone marrow concentrate for knee osteoarthritis with and without adipose graft." BioMed research international 2014 (2014).
- Toh WS, Foldager CB, Pei M. Advances in Mesenchymal Stem Cell-based Strategies for Cartilage Repair and Regeneration. Stem Cell Rev Rep. 2014;10:686-696. doi:10.1007/s12015-014-9526-z.
- Centeno, Christopher J., et al. "Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells, platelet lysate and dexamethasone." Annals of Transplantation 9 (2008): 246-251.
- Orozco, Lluis, et al. " Treatment of knee osteoarthritis with autologous mesenchymal stem cells: two-year follow-up results." Transplantation 97.11 (2014): e66-e68.
- Filardo, Giuseppe, et al. " Mesenchymal stem cells for the treatment of cartilage lesions: from preclinical findings to clinical application in orthopaedics." Knee surgery, sports traumatology, arthroscopy 21.8 (2013): 1717-1729.
- Jo, Chris Hyunchul, et al. " Intra?articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof?of?concept clinical trial." Stem cells 32.5 (2014): 1254-1266.
- Vangsness, C. Thomas, et al. " Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy." J Bone Joint Surg Am 96.2 (2014): 90-98.
- Zhao J, Huang H, Liang G, Zeng LF, Yang W, Liu J.
Effects and safety of the combination of platelet-rich plasma (PRP) and hyaluronic acid (HA) in the treatment of knee osteoarthritis: a systematic review and meta-analysis.
BMC Musculoskelet Disord. 2020 Apr 11;21(1):224. doi: 10.1186/s12891-020-03262-w. PMID: 32278352 Free PMC article. - Khoshbin A, Leroux T, Wasserstein D, Marks P, Theodoropoulos J, Ogilvie-Harris D, Gandhi R, Takhar K, Lum G, Chahal J.
The efficacy of platelet-rich plasma in the treatment of symptomatic knee osteoarthritis: a systematic review with quantitative synthesis.
Arthroscopy. 2013 Dec;29(12):2037-48. doi: 10.1016/j.arthro.2013.09.006. PMID: 24286802 Review. - Cole BJ, Karas V, Hussey K, Pilz K, Fortier LA.
Hyaluronic Acid Versus Platelet-Rich Plasma: A Prospective, Double-Blind Randomized Controlled Trial Comparing Clinical Outcomes and Effects on Intra-articular Biology for the Treatment of Knee Osteoarthritis.
Am J Sports Med. 2017 Feb;45(2):339-346. doi: 10.1177/0363546516665809. Epub 2016 Oct 21. PMID: 28146403 Clinical Trial. - Shen L, Yuan T, Chen S, Xie X, Zhang C.
The temporal effect of platelet-rich plasma on pain and physical function in the treatment of knee osteoarthritis: systematic review and meta-analysis of randomized controlled trials.
J Orthop Surg Res. 2017 Jan 23;12(1):16. doi: 10.1186/s13018-017-0521-3. PMID: 28115016 Free PMC article. Review. - Lin KY, Yang CC, Hsu CJ, Yeh ML, Renn JH.
Intra-articular Injection of Platelet-Rich Plasma Is Superior to Hyaluronic Acid or Saline Solution in the Treatment of Mild to Moderate Knee Osteoarthritis: A Randomized, Double-Blind, Triple-Parallel, Placebo-Controlled Clinical Trial.
Arthroscopy. 2019 Jan;35(1):106-117. doi: 10.1016/j.arthro.2018.06.035. PMID: 30611335 Clinical Trial.